Графическое изображение формул солей
По единым номенклатурным правилам, разработанным в комиссиях Международного союза теоретической и прикладной химии (ИЮПАК) в 1979 г., рекомендуется называть неорганические соединения слева направо в именительном падеже, хотя в традициях русской номенклатуры принято называть сначала электроотрицательную составляющую соединения (анион), а затем – электроположительную (катион) в родительском падеже.
Стехиометрические отношения элементов в соединениях можно выражать тремя способами:
1. С помощью приставок из греческих числительных.
Для обозначения числа атомов одинаковых элементов в молекулах простых и сложных веществ употребляют приставки из греческих числительных:
| 1 – моно (обычно не называют) 2 – ди 3 – три 4 – тетра | 5 – пента 6 – гекса 7 – гепта 8 – окта | 9 – нона 10 – дека 11 – ундека 12 – додека |
Для обозначения количества сложных групп атомов (кислотные остатки кислородсодержащих кислот) употребляют латинское «бис», греческие «трис», «тетракис», а группу атомов, к которой они относятся, заключают в круглые скобки.
Примеры: Н 2 – диводород, О 3 – трикислород, Р 2 О 5 – дифосфор пентаоксид, FeCl 2 – железо дихлорид, Ca(NO 3) 2 – кальций бис(нитрат), Fe 2 (CO 3) 3 – дижелезо трис(карбонат).
2. По системе Штока
После названия элемента в круглых скобках римской цифрой указывают его степень окисления.
Примеры: FeCl 3 – железо (III) хлорид, Mn 2 O 7 – марганец (VII) оксид.
3. По системе Эвенса-Бассета.
После названия иона в круглых скобках пишут его заряд арабской цифрой и знак заряда.
Примеры: Cu(NO 3) 2 – медь (2+) нитрат, FeCl 3 – железо (3+) хлорид.
Систему Эвенса-Бассета используют чаще всего в названиях комплексных соединений.
Графические формулы
При написании графических (структурных) формул соединений необходимо соблюдать 2 правила:
1. Каждая связующая электронная пара (связь) между атомами обозначается черточкой (штрихом). Число черточек соответствует степени окисления элемента, взятой по абсолютной величине.
2. «Электроположительные» атомы могут соединяться только с «электроотрицательными» (имеющими отрицательную степень окисления).
Оксиды
Основания
Основные правила названий кислот и их анионов приведены в теоретическом разделе, посвященном классам неорганических соединений. Ниже приведены названия некоторых, не вошедших в список ранее названных, кислот и их анионов, а также графические формулы наиболее распространенных кислот
| Формула кислоты | Название кислоты | Название аниона кислоты |
| HBr | бромоводородная | бромид |
| HI | йодоводородная | йодид |
| HCH 3 COO | уксусная | ацетат |
| H 2 C 2 O 4 | щавелевая | оксалат |
| H 2 C 4 H 4 O 6 | винная | тартрат |
| H 3 BO 4 | ортоборная | солей нет |
| (HBO 2) 2 | метаборная (кислоты не существует, только соль) | метаборат |
| H 2 B 4 O 7 | тетраборная (кислоты не существует, только соль) | тетраборат |
| H 3 PO 3 | фосфористая | фосфит |
| H 3 AsO 4 | (орто) мышьяковая | (орто) арсенат |
| H 3 AsO 3 | (орто) мышьяковистая | (орто) арсенит |
| H 3 SbO 4 | (орто) сурьмяная | (орто) антимонат |
| HSbO 3 | метасурьмяная | метаантимонат |
| H 3 SbO 3 | (орто) сурьмянистая | (орто) антимонит |
| HSbO 2 | метасурьмянистая | метаантимонит |
| H 2 MnO 4 | марганцовая | манганат |
угольная серная сернистая азотная
фосфорная хромовая дихромовая пирофосфорная
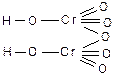
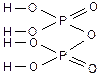
тетраборная
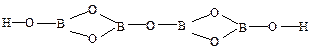
перхлорная пермарганцовая метесурьмяная
![]()
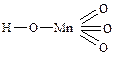
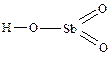
Сначала называется электроположительная составляющая солей (катион) в именительном падеже, а затем – электроотрицательная (анион).
Средние соли
Примеры (номенклатура с приставками из греческих числительных и по системе Штока):
Кислые соли
В названии солей, содержащих не полностью замещенный в кислоте водород, перед названием кислотного остатка без пробела называется слово «водород» с указанием, в случае необходимости, числа его атомов.

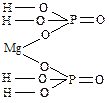

Основные и оксидные соли
В названиях солей, содержащих одну или несколько групп ОН, после названия металла употребляется слово «гидроксид» с указанием числа гидроксидных групп, принадлежащих одному атому металла, а затем следует название аниона.
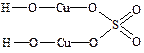

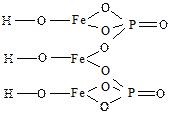
Примеры выполнения контрольных заданий № 3 и № 4
Ответ:
1. 2Ca + O 2 ® 2CaO
2. CaO + H 2 O ® Ca(OH) 2
3. 3Ca(OH) 2 + 2H 3 PO 4 ® Ca 3 (PO 4) 2 ¯ + 6H 2 O
4. 4P + 5O 2 (изб) 2P 2 O 5
5. P 2 O 5 + 3H 2 O ® 2H 3 PO 4
6. 2H 3 PO 4 + 3Ca(OH) 2 ® Ca 3 (PO 4) 2 ¯ + 6H 2 O
Пример 2. Покажите взаимную связь между соединениями с помощью химических уравнений.
![]()
Примечание: ОВР уравняйте одним из методов – МЭБ или МПР.
Пример 3. К растворам каждого из веществ Zn(NO 3) 2 , NaOH, H 2 CO 3 , Be(OH) 2 добавили избыток калий гидроксида. Напишите молекулярные и ионные уравнения возможных реакций.
Ответ:
- Zn(NO 3) 2 + 4KOH (изб.) ® 2KNO 3 + K 2 ZnO 2 + 2H 2 O
Zn 2+ + 2NO 3 – + 4K + + 4OH – ® 2K + + 2NO 3 – + 2K + + ZnO 2 2– + 2H 2 O
Zn 2+ + 4OH – ® ZnO 2 2– + 2H 2 O
H 2 CO 3 + 2K + + 2OH – ® 2K + + CO 3 2– +2H 2 O
H 2 CO 3 + 2OH – ® CO 3 2– +2H 2 O
Be(OH) 2 + 2K + + 2OH – ® 2K + + BeO 2 2– +2H 2 O
Be(OH) 2 + 2OH – ® BeO 2 2– +2H 2 O
или Be(OH) 2 + 2KOH (изб.) K 2
Be(OH) 2 + 2K + + 2OH – ® 2K + + 2–
Be(OH) 2 + 2OH – ® 2–
Пример 4. Подберите по 2 молекулярных уравнения для реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Ba 2+ + CO 3 2– ® BaCO 3
б) Ca 2+ + SiO 3 2– ® CaSiO 3
Ответ:
- Ba(OH) 2 + Na 2 CO 3 ® BaCO 3 ¯ + 2NaOH
Ba 2+ + 2OH – + 2Na + + CO 3 2– ® BaCO 3 + 2Na + + 2OH –
Ba 2+ + CO 3 2– ® BaCO 3 ¯
- Ba(NO 3) 2 + K 2 CO 3 ® BaCO 3 ¯ + 2KNO 3
Ba 2+ + 2NO 3 – + 2K + + CO 3 2– ® BaCO 3 + 2K + + 2NO 3 –
Ba 2+ + CO 3 2– ® BaCO 3 ¯
- Ca(OH) 2 + Na 2 SiO 3 ® CaSiO 3 ¯ + 2NaOH
Ca 2+ + 2OH – + 2Na + + SiO 3 2– ® CaSiO 3 + 2Na + + 2OH –
Ca 2+ + SiO 3 2– ® CaSiO 3 ¯
- CaCl 2 + K 2 SiO 3 ® CaSiO 3 ¯ + 2KCl
Ca 2+ + 2Cl – + 2K + + SiO 3 2– ® CaSiO 3 ¯ + 2K + + 2Cl –
Ca 2+ + SiO 3 2– ® CaSiO 3 ¯
Пример 5. Смесь CaO и CaSO 3 массой 80 г обработали раствором соляной кислоты. При этом выделилось 7,84 л газа (н.у.). Определите массовую долю в % CaO в смеси.
Решение:
Оба компонента смеси взаимодействуют с кислотой:
- CaO + 2HCl ® CaCl 2 + H 2 O
- CaSO 3 + 2HCl ® CaCl 2 + SO 2 + H 2 O
но т.к. газ (SO 2) выделяется во второй реакции, то можно составить пропорцию
![]() , решая которую найдем массу CaSO 3
, решая которую найдем массу CaSO 3
![]()
Ответ: массовая доля CaO в смеси составляет 47,5%.
Пример 6. Через раствор, содержащий 10 г NaOH попустили H 2 S массой 20г. Какая соль образовалась при этом? Определите ее массу.
Решение:
При взаимодействии NaOH с H 2 S возможны две реакции:
- NaOH + H 2 S ® NaHS + H 2 O
- 2NaOH + H 2 S ® Na 2 S + 2H 2 O
Для выбора идущей реакции необходимо выяснить количества реагирующих веществ NaOH и H 2 S и определить, какое из них находится в недостатке.
![]() моль
моль
![]() моль
моль
Из сравнения n(NaOH) и n(H 2 S) следует, что NaOH находится в недостатке, поэтому пойдет первая реакция, для которой нужно меньше вещества NaOH.
I способ:
Для нахождения массы соли NaHS составим пропорцию:
![]() , откуда
, откуда
![]() (г)
(г)
II способ:
Исходя из того, что по уравнению реакции 1 n(NaOH) = n(NaHS), можно вычислить m(NaHS) по формуле:
Ответ: образуется кислая соль NaHS, ее масса равна 14 г.
Пример 7. Какая соль образуется при пропускании всего углерод (IV) оксида, получившегося при сжигании метана объемом 2,24 л. (н.у.) через раствор объемом 19,1 мл с массовой долей натрий гидроксида 32% (ρ=1,35 г/мл)? Определите массовую долю (в %) соли в полученном растворе.
Решение:
Уравнение реакции горения метана:
CH 4 + 2O 2 ® CO 2 + 2H 2 O (1)
При пропускании углекислого газа через раствор щелочи можно предположить образование средней соли:
CO 2 + 2NaOH ® Na 2 CO 3 + H 2 O (2)
Расчет количества вещества реагентов:
![]() моль;
моль;
Из уравнения (1) следует, что n(CH 4) = n(CO 2) = 0,1 моль. Для нахождения n(NaOH) необходимо рассчитать массы раствора и вещества NaOH.
![]() моль
моль
Из уравнения (2) следует, что n(CO 2):n(NaOH) = 1:2. Рассчитанные количества CO 2 и NaOH находятся в эквивалентных количествах, т.е. 1:2, поэтому образуется средняя соль Na 2 CO 3 .
Количество Na 2 CO 3 равно n(Na 2 CO 3) = n(CO 2) = 0,1 моль, тогда:
В результате пропускания углекислого газа через раствор щелочи масса раствора увеличилась на массу CO 2:
25,78 г + 4,4 г = 30,18 г.
Массовая доля Na 2 CO 3 равна:
Ответ: образуется средняя соль Na 2 CO 3 , ее массовая доля равна 35,1%.
Пример 8 . Rp.: Ag. Plumbi 50,0
Acidi borici 2,0
Ag. Destill. аd. 100,0
Решение: В данном рецепте в 100 г раствора содержится 2 г H 3 BO 3 , следовательно, ее массовая доля составляет 0,02 или 2%.
Ответ: массовая доля 2%.
Контрольное задание № 3
1. Классификация сложных веществ. Основания. Сравнительная характеристика щелочей и амфотерных гидроксидов. Их получение и свойства.
2. К растворам каждого из веществ: Mn(NO 3) 2 , Cr(OH) 3 , H 2 CO 3 , CaCl 2 , NH 4 OH добавили избыток натрий гидроксида. Напишите молекулярные и ионные уравнения возможных реакций.
3. Подберите по 2 молекулярных уравнения для реакций, которые выражаются следующими ионно-молекулярными уравнениями:
Fe 3+ + 3OH - ® Fe(OH) 3
CrO 4 2- + Ba 2+ ® BaCrO 4
Ag + + Cl - ® AgCl
4. В растворах данных солей укажите реакцию среды: NaSCN, ZnSO 4 , Na 2 CuO 2 . Для гидролизующихся солей приведите молекулярные и ионные уравнения.
5. Допишите реакции образования К.С., назовите продукты, составьте выражения для К нест. комплексных ионов:
а) ![]()
б) ![]()
6. Уравняйте ОВР, пользуясь ионно-электронным методом:
а) MnSO 4 +NaBiO 3 +HNO 3 ®HMnO 4 +Bi(NO 3) 3 +NaNO 3 +Na 2 SO 4 +H 2 O
б) KCrO 2 + Br 2 + KOH ® K 2 CrO 4 + KBr + H 2 O
7. Покажите взаимную связь между соединениями с помощью химических уравнений:
а) K ® KOH ® K 2 S ® KHS ® K 2 S ® KCl ® K
б) Zn ® ZnO ® Zn(OH) 2 ® Na 2 ZnO 2 ® Zn(NO 3) 2 ® Na 2
8. Смесь железа и цинка в количестве 15 г обработали раствором калий гидроксида. При этом выделилось 3,2 л газа (при н.у.). Определите процентный состав смеси.
9. Биороль элементов подгруппы цинка. Токсические свойства соединений кадмия и ртути. Применение в медицине и фармации.
10. Напишите эмпирические и графические формулы солей, дайте вторые названия с приставками из греческих числительных:
а) медь (II) гидроксид сульфат
б) стронций (II) водород(орто)арсенит.
Контрольное задание № 4
1. Укажите степени окисления (С.О.) элементов IVA-группы. Как изменяются К.О. и О.В. свойства с ростом величины С.О. Приведите примеры реакций. Укажите токсичные соединения и применение в медицине соединений углерода, кремния, олова и свинца.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) HCl ® Cl 2 ® KClO ® KCl ® AgCl ® Cl ® AgCl
б) NH 4 NO 2 ® N 2 ® NH 3 ® NH 4 NO 3 ® N 2 O ® NO ® NO 2 ® HNO 3
3. Допишите и уравняйте ОВР, пользуясь МПР; укажите окислитель и восстановитель:
а) K 2 Cr 2 O 7 + K 2 S + H 2 SO 4 ®
б) NH 3 + KMnO 4 + KOH ®
4. Напишите уравнения всех возможных реакций между веществами, взятыми попарно: K 2 O, P 2 O 5 , Ba(OH) 2 , H 2 SO 4 , KI, Pb(NO 3) 2 . Уравнения реакций, протекающих в растворах, изобразите в сокращенной ионной форме.
5. Напишите уравнения реакций гидролиза солей Na 2 B 4 O 7 и Sn(NO 3) 4 в молекулярной и ионной формах. Укажите реакцию среды.
6. Допишите реакции образования К.С., назовите продукты реакций:
а) ![]() б)
б) ![]()
7. Какую массу раствора с массовой долей фосфорной кислоты 40% можно получить из фосфорита массой 100 кг с массовой долей Ca 3 (PO 4) 2 93%?
8. Остаток, полученный после термического разложения хлората калия в присутствии оксида марганца (IV), растворили в воде. К раствору добавили избыток раствора AgNO 3 , получив осадок массой 57,4 г. Какой объем кислорода выделился при разложении хлората (н.у.)?
9. Rp: Sol. Natrii thiosulfatus 10% - 200,0.
D.S. По 2 столовые ложки через каждые 5-10 минут.
Рассчитайте дозу тиосульфата натрия на прием (масса раствора в столовой ложке 15 г).
10. Напишите эмпирические и графические формулы, дайте названия по номенклатуре с приставками из греческих числительных:
а) цинк (II) водородсульфид
б) алюминий (III) дигидроксид фосфат.
Студент должен уметь:
1. Самостоятельно работать с учебной и справочной литературой по общей и неорганической химии.
2. Владеть основными приемами и техникой выполнения экспериментов по общей и неорганической химии.
3. Пользоваться основными неорганическими реактивами, растворителями и химической посудой.
4. Правильно использовать номенклатуру неорганических соединений.
5. Рассчитывать основные энергетические характеристики химических процессов.
6. Готовить растворы с заданной концентрацией растворенных веществ.
7. Прогнозировать возможность образования осадков при смешивании растворов с известной концентрацией растворенных веществ.
Студент должен знать:
1. Цели, задачи общей и неорганической химии, пути и способы их решения.
2. Роль и значение методов общей и неорганической химии в фармации, в практической деятельности провизора, исследователя в области фармации.
3. Основные разделы общей и неорганической химии. Основные понятия и методы общей и неорганической химии.
4. Основные этапы развития общей и неорганической химии, ее современное состояние.
5. Связь свойств соединений с положением составляющих их элементов в Периодической системе химических элементов Д.И. Менделеева.
6. Пути расчета энергетических характеристик химических процессов, определение направления и глубины их протекания, способы расчета химических равновесий по известным исходным концентрациям и константе равновесия.
7. Основу теории строения неорганических веществ, теории химической связи.
8. Основные свойства химических элементов и их соединений.
9. Основные типы неорганических соединений.
10. Современную номенклатуру неорганических соединений.
11. Основные литературные источники и справочную литературу по общей и неорганической химии.
12. Основные правила охраны труда и техники безопасности при работе в химической лаборатории.
Вопросы к экзамену по неорганической химии
(1 курс фарм.ф-та СибГМУ, заочная форма обучения).
1. Строение атома; строение ядра; элементарные частицы. Изотопы.
2. Электронное строение атома. Главное и орбитальное квантовые числа.
3. Магнитное и спиновое квантовые числа.
4. Электронные формулы атомов. Валентные электроны. Принцип Паули.
5. Электронно-графические схемы атомов. Правило Гунда.
6. Периодический закон Д.И. Менделеева. Периодическая система и ее структура: периоды (большие и малые); группы, подгруппы.
7. Изменение металлических и неметаллических свойств элементов по периодам и группам. Деление элементов на семейства: s-, p-, d-, f-.
8. Механизм образования ковалентной связи (метод ВС). Насыщаемость и направленность; характер перекрывания орбиталей.
9. Ионная связь, ее свойства. Металлическая связь.
10. Характеристики химических связей: энергия, длина, валентный угол, полярность. Водородная связь.
11. Понятие скорости химической реакции. Химическое равновесие.
12. Основные положения теории строения комплексных соединений. Понятия: центральный ион, лиганды, комплексный ион, внешняя сфера.
13. Классификация комплексных соединений, номенклатура. Химические свойства комплексных соединений.
14. Диссоциация комплексных соединений. Константа нестойкости. Способы получения комплексных соединений.
15. Электронная теория окислительно-восстановительных реакций Л.В.Писаржевского. Типичные окислители и восстановители. Окислительно-восстановительная двойственность.
16. Понятие растворов; их классификация по различным признакам. Растворимость газообразных, жидких и твердых веществ.
17. Механизм растворения электролитов. Диссоциация кислот, оснований и солей.
18. Степень диссоциации, факторы, влияющие на ее величину; сильные и слабые электролиты.
19. Ионное произведение воды. Водородный и гидроксильный показатель, рН растворов сильных и слабых кислот и оснований.
20. Гидролиз солей. Степень гидролиза; факторы, влияющие на ее величину.
21. Водород. Водород пероксид. Их химические свойства.
22. Щелочные и щелочно-земельные металлы, их химические свойства.
23.Основные химические свойства d-элементов.
24.Азот, его соединения. Азотная кислота, ее химические свойства.
25.Сера, ее соединения. Серная кислота, ее химические свойства.
Эмпирические формулы дают информацию о качественном и количественном составе соединений. Взаимное расположение атомов в молекуле вещества отражают структурно-графические формулы, однако они не показывают пространственное расположение атомов.
При составлении структурно-графических формул можно руководствоваться следующими правилами:
1. Элементы соединяются в соответствии с их валентностью.
2. Черточка в формуле обозначает единичную химическую связь, количество черточек соответствует валентности, например:
K 2 O записывается так: K‑O ‑K .
3. Состав кислот и оснований следует начинать изображать с центрального атома,
4. Если в молекуле кислоты содержится больше атомов кислорода, чем водорода, то «избыточные» атомы кислорода соединены с центральным атомом двойной связью,
5. При написании графических формул солей исходят из графических формул кислот, заменяя атомы водорода на атомы металла, учитывая его валентность, например:
Структурно-графические формулы некоторых кислот приведены в табл. 5.
2.4. Общие химические свойства основных классов
неорганических веществ
Оксиды ‑ вещества, состоящие из атомов двух элементов, один из которых – кислород в степени окисления (–2). По химическим свойствам их подразделяют на индифферентные, или несолеобразующие (CO, NO), и солеобразующие, которые бывают основными, кислотными и амфотерными.
Химические свойства основных оксидов
1. Взаимодействуют с кислотами с образованием соли и воды, например:
MgO + 2HCl = MgCl 2 + H 2 O.
2. Взаимодействие с кислотными оксидами с образованием солей:
CaO + CO 2 = CaCO 3 .
3. Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием растворимых в воде оснований – щелочей:
K 2 O + H 2 O = 2KOH.
Химические свойства кислотных оксидов
1. Общим свойством всех кислотных оксидов является их способность взаимодействовать с основаниями с образованием соли и воды:
СО 2 + 2NaOH = Na 2 CO 3 + Н 2 О.
2. Кислотные оксиды взаимодействуют с основными оксидами с образованием солей.
3. Большинство кислотных оксидов взаимодействует с водой с образованием кислот:
SО 3 + Н 2 О = H 2 SO 4 .
Очень немногие кислотные оксиды не взаимодействуют с водой. Наиболее известный из них оксид кремния (SiO 2).
Химические свойства амфотерных оксидов
1. Амфотерные оксиды взаимодействуют с кислотами с образованием солей и воды.
ZnO + 2HNO 3 = Zn(NO 3) 2 + 2Н 2 О.
В этих реакциях амфотерные оксиды играют роль основных.
2. Амфотерные оксиды взаимодействуют с щелочами с образованием солей и воды.
ZnO + 2КОН ![]() K 2 ZnO 2 + Н 2 О,
K 2 ZnO 2 + Н 2 О,
ZnO + 2КОН + H 2 O K 2 .
В этих реакциях амфотерные оксиды играют роль кислотных.
3. Амфотерные оксиды при нагревании взаимодействуют с кислотными оксидами с образованием солей:
ZnO + CO 2 = ZnCO 3 .
4. Амфотерные оксиды при нагревании взаимодействуют с основными оксидами с образованием солей:
ZnO + Na 2 O = Na 2 ZnO 2 .
Получение оксидов
Оксиды могут быть получены различными способами:
1. Взаимодействием простых веществ с кислородом:
2Mg + О 2 = 2MgO;
2. Разложением некоторых оксокислот:
H 2 SO 3 = SO 2 + Н 2 О.
3. Разложением нерастворимых оснований:
Сu(OH) 2 CuO+ H 2 O.
4. Разложением некоторых солей:
СаСО 3 СаО + СО 2 .
Основания ‑сложные вещества, при диссоциации которых в воде образуются гидроксид-ионы и никаких других анионов.
По растворимости в воде основания делятся на две группы: нерастворимые и растворимые в воде [КОН, NaOH, Са(ОН) 2 , Ва(ОН) 2 ], или щелочи.
Химические свойства оснований
Общие свойства оснований объясняются наличием в растворах анионов ОН - , которые образуются в результате электролитической диссоциации молекул оснований:
NaOH Na + + OH - .
1. Водные растворы щелочей изменяют окраску индикаторов.
Таблица 6 ‑ Изменение цвета индикаторов в растворах
щелочей и кислот
2. Основания взаимодействуют с кислотами с образованием соли и воды (реакция нейтрализации). Например:
КОН + НС1= КС1 + Н 2 О;
Fe(OH) 2 +2HNO 3 = Fe(NO 3) 2 + 2Н 2 О.
3. Щелочи взаимодействуют с кислотными оксидами с образованием соли и воды:
Са(ОН) 2 + СО 2 = СаСО 2 + Н 2 О.
4. Растворы щелочей взаимодействуют с растворами солей, если в результате образуется нерастворимое основание или нерастворимая соль. Например:
2NaOH + CuSO 4 = Cu(OH) 2 ↓ + Na 2 SO 4 ;
Ва(ОН) 2 + Na 2 SO 4 = 2NaOH + BaSO 4 ↓.
5. Нерастворимые основания при нагревании разлагаются на основный оксид и воду.
2Fе(ОН) 3 Fе 2 О 3 + ЗН 2 О.
6. Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды (Zn, Al и др.).
2AI + 2КОН + 6Н 2 О = 2K + 3H 2 .
Получение оснований
1. Получение растворимых оснований :
а) взаимодействием щелочных и щелочноземельных металлов с водой:
2Na + 2Н 2 О = 2NaOH + Н 2 ;
б) взаимодействием оксидов щелочных и щелочноземельных металлов с
Na 2 O + Н 2 О = 2NaOH.
2. Получение нерастворимых оснований действием щелочей на растворимые соли металлов:
2NaOH + FeSO 4 = Fe(OH) 2 ↓ + Na 2 SO 4 .
Кислоты ‑ сложные вещества, при диссоциации которых в воде, образуются ионы водорода (гидроксония) и никаких других катионов.
Химические свойства
Общие свойства кислот в водных растворах обусловлены присутствием ионов Н + (вернее H 3 O +), которые образуются в результате электролитической диссоциации молекул кислот:
1. Кислоты одинаково изменяют цвет индикаторов (табл. 7).
2. Кислоты взаимодействуют с основаниями. Например:
Н 3 РО 4 + 3NaOH=Na 3 PO 4 +ЗН 2 О;
Н 3 РО 4 + 2NaOH = Na 2 HPO 4 + 2Н 2 О;
Н 3 РО 4 + NaOH = NaH 2 PO 4 + Н 2 О;
2НС1 + Сu(ОН) 2 = СuС1 2 + 2Н 2 О;
НС1 + Сu(ОН) 2 = СuОНСl + Н 2 О.
3. Кислоты взаимодействуют с основными оксидам:
2НСl + СаО = СаС1 2 + Н 2 О;
H 2 SO 4 +Fe 2 O 3 =Fe 2 (SO 4) 3 + ЗН 2 О.
4. Кислоты взаимодействуют с амфотерными оксидами:
2HNO 3 + ZnO = Zn(NO 3) 2 + Н 2 О.
5. Кислоты взаимодействуют с некоторыми средними солями с образованием новой соли и новой кислоты, реакции возможны в том случае, если в результате образуется нерастворимая соль или более слабая (или более летучая) кислота, чем исходная. Например:
2НС1+Na 2 CO 3 =2NaCl+H 2 CO 3 ;
NaCl + H 2 SO 4 = HCl + Na 2 SO 4 .
6. Кислоты взаимодействуют с металлами. Характер продуктов этих реакций зависит от природы и концентрации кислоты и от активности металла. Например, разбавленная серная кислота, хлороводородная кислота и другие кислоты‑неокислители взаимодействуют с металлами, которые находятся в электрохимическом ряду напряжения левее водорода. В результате реакции образуются соль и газообразный водород:
H 2 SO 4 (разб)) + Zn = ZnSO 4 + Н 2 ;
НС1 + Mg = MgО + H 2 .
Кислоты-окислители (концентрированная серная кислота, азотная кислота HNO 3 любой концентрации) взаимодействуют и с металлами, стоящими в ряду напряжения после водорода с образованием соли и продукта восстановления кислоты. Например:
2H 2 SO 4 (конц) + Zn = ZnSO 4 +SO 2 + 2H 2 O;
Получение кислот
1. Бескислородные кислоты получают путем синтеза из простых веществ и последующим растворением продукта в воде.
S + Н 2 = Н 2 S.
2. Оксокислоты получают взаимодействием кислотных оксидов с водой.
SO 3 + Н 2 О = H 2 SО 4 .
3. Большинство кислот можно получить взаимодействием солей с кислотами.
Na 2 SiО 3 + H 2 SO 4 = H 2 SiО 3 + Na 2 SO 4 .
Для того чтобы изобразить формулу соли графически, следует:
1. Правильно написать эмпирическую формулу этого соединения.
2. Учитывая, что любая соль может быть представлена как продукт нейтрализации соответствующих кислоты и основания, следует изобразить отдельно формулы кислоты и основания, образовавших данную соль.
Например :
Ca(HSO 4) 2 - гидросульфат кальция можно получить при неполной нейтрализации серной кислоты H 2 SO 4 гидроксидом кальция Са(ОН) 2 .
3. Определить, какое количество молекул кислоты и основания требуется для получения молекулы этой соли.
Например :
Для получения молекулы Ca(HSO 4) 2 требуется одна молекула основания (один атом кальция) и две молекулы кислоты (два кислотных остатка НSО 4 -1 ).
Са(ОН) 2 + 2H 2 SO 4 = Ca(HSO 4) 2 + 2H 2 O
Построить графические изображения формул установленного числа молекул основания и кислоты и, мысленно убрав, участвующие в реакции нейтрализации и образующие воду, анионы гидроксила основания и катионы водорода кислоты, получить графическое изображение формулы соли:
H - O O H - O O
![]() S S
S S
O – H H - O O O O
![]() Сa + → Ca + 2 H-O-H
Сa + → Ca + 2 H-O-H
O – H H - O O O O
Физические свойства солей.
Соли представляют собой твердые кристаллические вещества. По растворимости в воде их можно подразделить на:
1) хорошо растворимые,
2) мало растворимые,
3) практически нерастворимые.
Большинство солей азотной и уксусной кислот, а также солей калия, натрия и аммония - растворимы в воде. Соли имеют широкий диапазон температур плавления и термического разложения.
Химические свойства солей.
Химические свойства солей характеризуют их отношение к металлам, щелочам, кислотам и солям.
1. Соли в растворах взаимодействуют с более активными металлами.
Более активный металл замещает менее активный металл в соли (см. ряд активностей металлов).
Например:
Рb(NO 3) 2 + Zn = Рb + Zn(NO 3) 2
Hg(NO 3) 2 + Cu = Нg + Cu(NO 3) 2
2. Растворы солей взаимодействуют со щелочами, при этом получаются новое основание и новая соль.
Например:
CuSO 4 + 2КОН = Сu(ОН) 2 ¯ + 2K 2 SO 4
FeCl 3 +3NаОН = Fe(OH) 3 ¯ + 3NaCl
3. Соли реагируют с растворами более сильных или менее летучих кислот, при этом получаются новая соль и новая кислота.
Например:
а) в результате реакции образуется более слабая кислота или более летучая кислота:
Na 2 S + 2НС1 = 2NaCl + H 2 S
б) Возможны и реакции с солей сильных кислот с более слабыми кислотами, если в результате реакции образуется малорастворимая соль:
СuSО 4 + Н 2 S = СuS¯ + H 2 SO 4
4. Соли в растворах вступают в обменные реакции с другими солями, при этом получаются две новые соли.
Например:
NaС1 + АgNO 3 = AgCl¯ + NaNO 3
CaCI 2 + Na 2 CO 3 = CaCO 3 ¯ + 2NaCl
CuSO 4 + Na 2 S = CuS¯ + Na 2 SO 4
Обменные реакции протекают практически до конца, если один из продуктов реакции выделяется из сферы реакции в виде осадка, газа или, если при реакции образуется вода или другой слабый электролит.
Способы получения солей.
Известно большое число реакций, приводящих к образованию солей. Приведем наиболее важные из них.
1. Взаимодействие кислот с основаниями (реакция нейтрализации):
NаОН + НNO 3 = NаNO 3 + Н 2 О
Al(OH) 3 + 3НС1 = AlCl 3 + 3Н 2 О
2. Взаимодействие металлов с кислотами:
Fе + 2HCl = FeCl 2 + Н 2
Zn + Н 2 SО 4 разб. = ZnSO 4 + Н 2
3. Взаимодействие кислот с основными и амфотерными оксидами:
СuO + Н 2 SO 4 = СuSO 4 + Н 2 О
ZnO + 2HCl = ZnСl 2 + Н 2 О
4. Взаимодействие кислот с солями:
FeCl 2 + H 2 S = FeS¯ + 2HCl
AgNO 3 + HCI = AgCl¯ + HNO 3
Ba(NO 3) 2 + H 2 SO 4 = BaSO 4 ¯ + 2HNO 3
5. Взаимодействие растворов двух различных солей:
BaCl 2 + Na 2 SO 4 = ВаSO 4 ¯ + 2NаСl
Pb(NO 3) 2 + 2NaCl = РbС1 2 ¯ + 2NaNO 3
6. Взаимодействие оснований с кислотными оксидами (щелочей с амфотерными оксидами):
Са(ОН) 2 + СО 2 = СаСО 3 ¯ + Н 2 О,
2NаОН (тв.) + ZnO Na 2 ZnO 2 + Н 2 О
7. Взаимодействие основных оксидов с кислотными:
СаO + SiO 2 СаSiO 3
Na 2 O + SO 3 = Na 2 SO 4
8. Взаимодействие металлов с неметаллами:
2К + С1 2 = 2КС1
Fе + S FеS
9. Взаимодействие металлов с солями.
Cu + Hg(NO 3) 2 = Hg + Cu(NO 3) 2
Pb(NO 3) 2 + Zn = Рb + Zn(NO 3) 2
10. Взаимодействие растворов щелочей с растворами солей
CuCl 2 + 2NaOH = Cu(OH) 2 ↓+ 2NaCl
NaHCO 3 + NaOH = Na 2 CO 3 + H 2 O
Применение солей.
Ряд солей являются соединениями необходимыми в значительных количествах для обеспечения жизнедеятельности животных и растительных организмов (соли натрия, калия, кальция, а также соли, содержащие элементы азот и фосфор). Ниже, на примерах отдельных солей, показаны области применения представителей данного класса неорганических соединений, в том числе, в нефтяной промышленности.
NаС1 - хлорид натрия (соль пищевая, поваренная соль). О широте использования этой соли говорит тот факт, что мировая добыча этого вещества составляет более 200 млн. т.
Эта соль находит широкое применение в пищевой промышленности, служит сырьем для получения хлора, соляной кислоты, гидроксида натрия, кальцинированной соды (Na 2 CO 3). Хлорид натрия находит разнообразное применение в нефтяной промышленности, например, как добавка в буровые растворы для повышения плотности, предупреждения образования каверн при бурении скважин, как регулятор сроков схватывания цементных тампонажных составов, для понижения температуры замерзания (антифриз) буровых и цементных растворов.
КС1 - хлорид калия. Входит в состав буровых растворов, способствующих сохранению устойчивости стенок скважин в глинистых породах. В значительных количествах хлорид калия используется в сельском хозяйстве в качестве макроудобрения.
Na 2 CO 3 - карбонат натрия (сода). Входит в состав смесей для производства стекла, моющих средств. Реагент для увеличения щелочности среды, улучшения качества глин для глинистых буровых растворов. Используется для устранения жесткости воды при ее подготовке к использованию (например, в котлах), широко используется для очистки природного газа от сероводорода и для производства реагентов для буровых и тампонажных растворов.
Al 2 (SO 4) 3 - сульфат алюминия. Компонент буровых растворов, коагулянт для очистки воды от тонкодисперсных взвешенных частиц, компонент вязкоупругих смесей для изоляции зон поглощения в нефтяных и газовых скважинах.
Nа 2 В 4 О 7 - тетраборат натрия (бура). Является эффективным реагентом - замедлителем схватывания цементных растворов, ингибитором термоокислительной деструкции защитных реагентов на основе эфиров целлюлозы.
BаSО 4 - сульфат бария (барит, тяжелый шпат). Используется в качестве утяжелителя (r » 4,5 г/см 3) буровых и тампонажных растворов.
Fе 2 SO 4 - сульфат железа (П) (железный купорос). Используется для приготовления феррохромлигносульфоната - реагента-стабилизатора буровых растворов, компонент высокоэффективных эмульсионных буровых растворов на углеводородной основе.
FеС1 3 - хлорид железа (Ш). В сочетании со щелочью используется для очистки воды от сероводорода при бурении скважин водой, для закачки в сероводородсодержащие пласты с целью снижения их проницаемости, как добавка к цементам с целью повышения их стойкости к действию сероводорода, для очистки воды от взвешенных частиц.
CaCO 3 - карбонат кальция в виде мела, известняка. Является сырьем для производства негашеной извести СаО и гашеной извести Ca(OH) 2 . Используется в металлургии в качестве флюса. Применяется при бурении нефтяных и газовых скважин в качестве утяжелителя и наполнителя буровых растворов. Карбонат кальция в виде мрамора с определенным размером частиц применяется в качестве расклинивающего агента при гидравлическом разрыве продуктивных пластов с целью повышения нефтеотдачи.
CaSO 4 - сульфат кальция. В виде алебастра (2СаSО 4 · Н 2 О) широко используется в строительстве, входит в состав быстротвердеющих вяжущих смесей для изоляции зон поглощений. При добавке к буровым растворам в виде ангидрита (СаSО 4) или гипса (СаSО 4 · 2Н 2 О) придает устойчивость разбуриваемым глинистым породам.
CaCl 2 - хлорид кальция. Используется для приготовления буровых и тампонажных растворов для разбуривания неустойчивых пород, сильно снижает температуру замерзания растворов (антифриз). Применяется для создания растворов высокой плотности, не содержащих твердой фазы, эффективных для вскрытия продуктивных пластов.
Nа 2 SiО 3 - силикат натрия (растворимое стекло). Используется для закрепления неустойчивых грунтов, для приготовления быстросхватывающихся смесей для изоляции зон поглощений. Применяется в качестве ингибитора коррозии металлов, компонента некоторых буровых тампонажных и буферных растворов.
AgNO 3 - нитрат серебра. Используется для химического анализа, в том числе пластовых вод и фильтратов буровых растворов на содержание ионов хлора.
Na 2 SO 3 - сульфит натрия. Используется для химического удаления кислорода (деаэрация) из воды в целях борьбы с коррозией при закачке сточных вод. Для ингибирования термоокислительной деструкции защитных реагентов.
Na 2 Cr 2 О 7 - бихромат натрия. Используется в нефтяной промышленности в качестве высокотемпературного понизителя вязкости буровых растворов, ингибитора коррозии алюминия, для приготовления ряда реагентов.
Вопросы для самоконтроля по теме соли
1. Дайте определения солям с точки зрения теории электролитической диссоциации (по Аррениусу).
2. Как подразделяются все соли?
3. Дайте определение: а) средняя соль, б) кислая соль, в) основная соль, г) двойная соль. Приведите примеры солей каждого типа.
4. Как называются следующие соли: Na 2 SO 4 , KHSO 4 , FeOHCl 2 , ZnCl 2 , (CuOH) 2 SO 2 , KAl(SO 4) 2 ? К какому типу солей они относятся? Напишите уравнения реакций их получения нейтрализацией соответствующей кислоты основанием.
Возможно, будет полезно почитать:
- Патриарх кирилл запретил актеру и священнику ивану охлобыстину служить в церкви Охлобыстин церковный сан ;
- Иван охлобыстин - биография, информация, личная жизнь Почему охлобыстин ушел из священников ;
- Ужин для ребенка 4 лет рецепты меню ;
- Принципы функционирования бюджетной системы РФ ;
- Особенности размещения населения на территории земли Население земли размещается равномерно средняя плотность населения ;
- Тонька-пулеметчица — cтрашная судьба страшного человека Фильм палач тонька пулеметчица реальная история ;
- Как поздравить начальницу с юбилеем? ;
- Российские студенты выиграли чемпионат мира по программированию Вот они, герои ;