Концентрированная серная кислота реагирует с растворимой солью. Список экзаменационных вопросов по дисциплине
Трехуровневый зачет вертушка 11 класс
Тема: «НЕМЕТАЛЛЫ»
Форма урока: зачет
Цель : проверить усвоение знаний учащихся по теме: «Неметаллы»; обобщить знания об общих свойствах неметаллов и их соединений; продолжить формировать навыки применения знаний в нестандартных и жизненных ситуациях, с использованием индивидуальных и дифференцированных заданий.
Задачи :
1. Проверить обобщить и закрепить знания учащихся о неметаллах и их соединениях; способствовать развитию умения мыслить логически и владеть химическим языком; переходу от формального – логического восприятия материала данной темы к образно-логическому мышлению с использованием разноуровневых, посильных и нестандартных задач.
2. Развить навыки наблюдения, выявления ошибок, решения задач, умения выделять главное, сравнивать изучаемые факты, логично излагать мысли и делать выводы; учить размышлять, делать предположения, прогнозировать.
3. Содействовать формированию основных мировоззренческих идей через познавательную активность и творческую самостоятельность учащихся.
4. Воспитывать умения работать самостоятельно с применением само- и взаимоконтроля. Показать связь изучаемой темы с жизнью. Воспитывать научное мировоззрение на основе взаимосвязи свойств и строения.
Оборудование и реактивы:
пробирки,
спиртовки, пробиркодержатели, спички и растворы:; ;
; ;
;
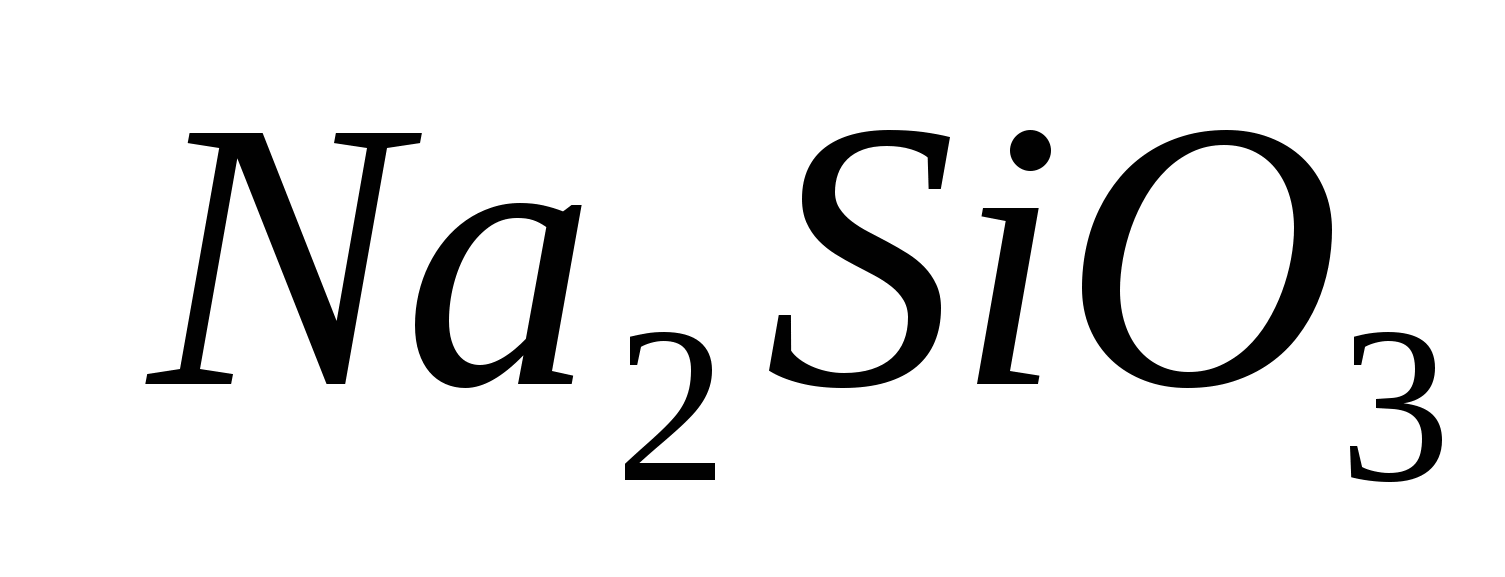 .
.
Подготовка к зачету.
Учитель готовит задания трех уровней сложности следующих видов: тест, теоретический вопрос, качественные и расчетные задачи, задание на превращение веществ.
Учитель готовит учеников, проверяющих задания.
За 1 – 2 недели в кабинете вывешивается информационный лист к зачету.
Каждому ученику выдается маршрутный лист. Очередность работы на этапах указывается в маршрутных листах.
МАРШРУТНЫЙ ЛИСТ.
Ф.И. ученика
Название этапа
Очередность этапов
№ задания
Подпись проверяющего
Расчетная задача
Распознавание
Превращение
Ход урока.
Учащиеся входят в класс с маршрутными листами, 5 чистыми листами, ручкой и идут на этап, обозначенный под № 1. Ученики выбирают задания по уровням сложности и отвечают на него письменно или устно, на этапе «распознавание веществ» выполняют эксперимент.
На работу на каждом этапе отводится 7 – 8 минут, проверяющий выставляет в маршрутный лист уровень, № задания, баллы за выполненное задание.
Оценка выставляется как среднее арифметическое всех этапов.
ПРИЛОЖЕНИЕ
«Распознавание веществ»
1 уровень
1. Докажите наличие иона 
2. Докажите наличие иона 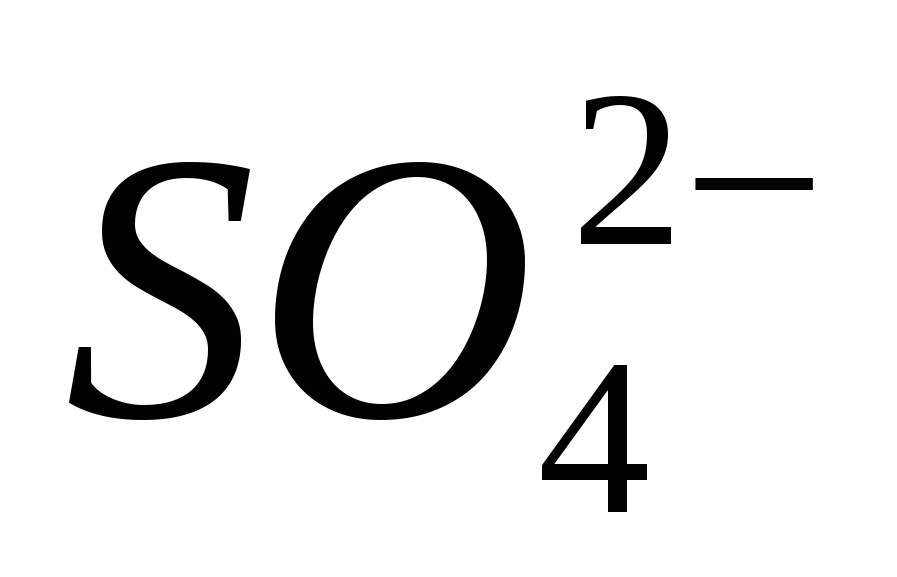
3. Докажите наличие иона 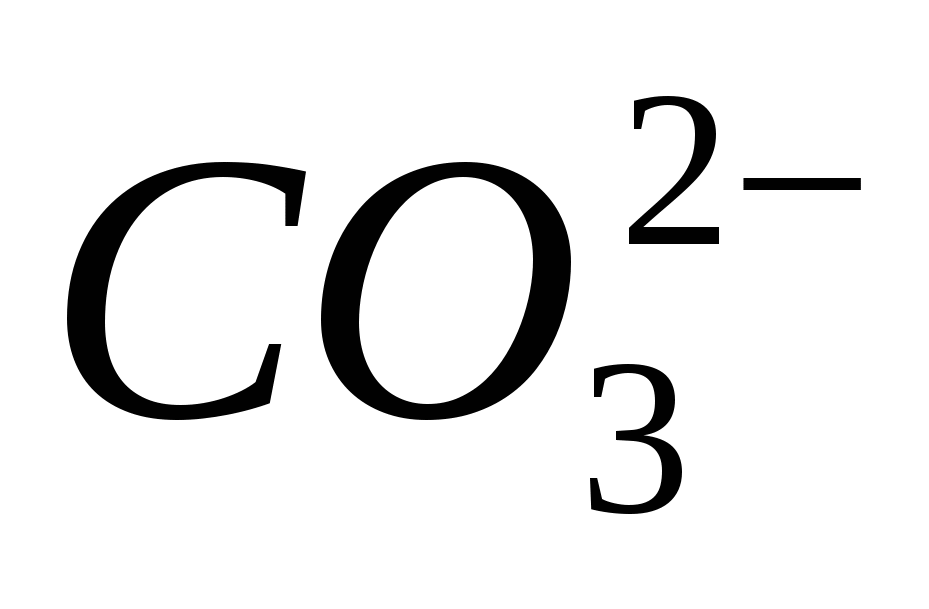
4. Докажите наличие иона 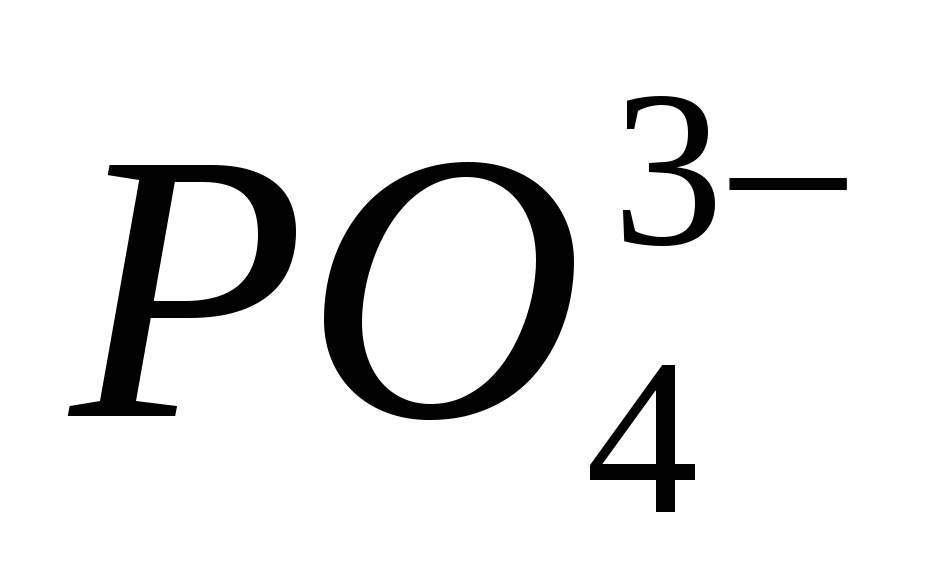
5. Докажите наличие иона 
2 уровень
1. Распознайте растворы с помощью одного реактива:
2. Распознайте растворы с помощью одного реактива:
3. Распознайте растворы с помощью одного реактива:
4. Распознайте растворы с помощью одного реактива: ;
;
5.Распознайте растворы с помощью одного реактива:
3 уровень
1. Распознать без дополнительных реактивов растворы:
2. Распознать без дополнительных реактивов растворы:
3. Распознать без дополнительных реактивов растворы:
4. Распознать без дополнительных реактивов растворы:
5. Распознать без дополнительных реактивов растворы:
Этап « Превращение веществ»
1 уровень
1. Закончить уравнения реакций
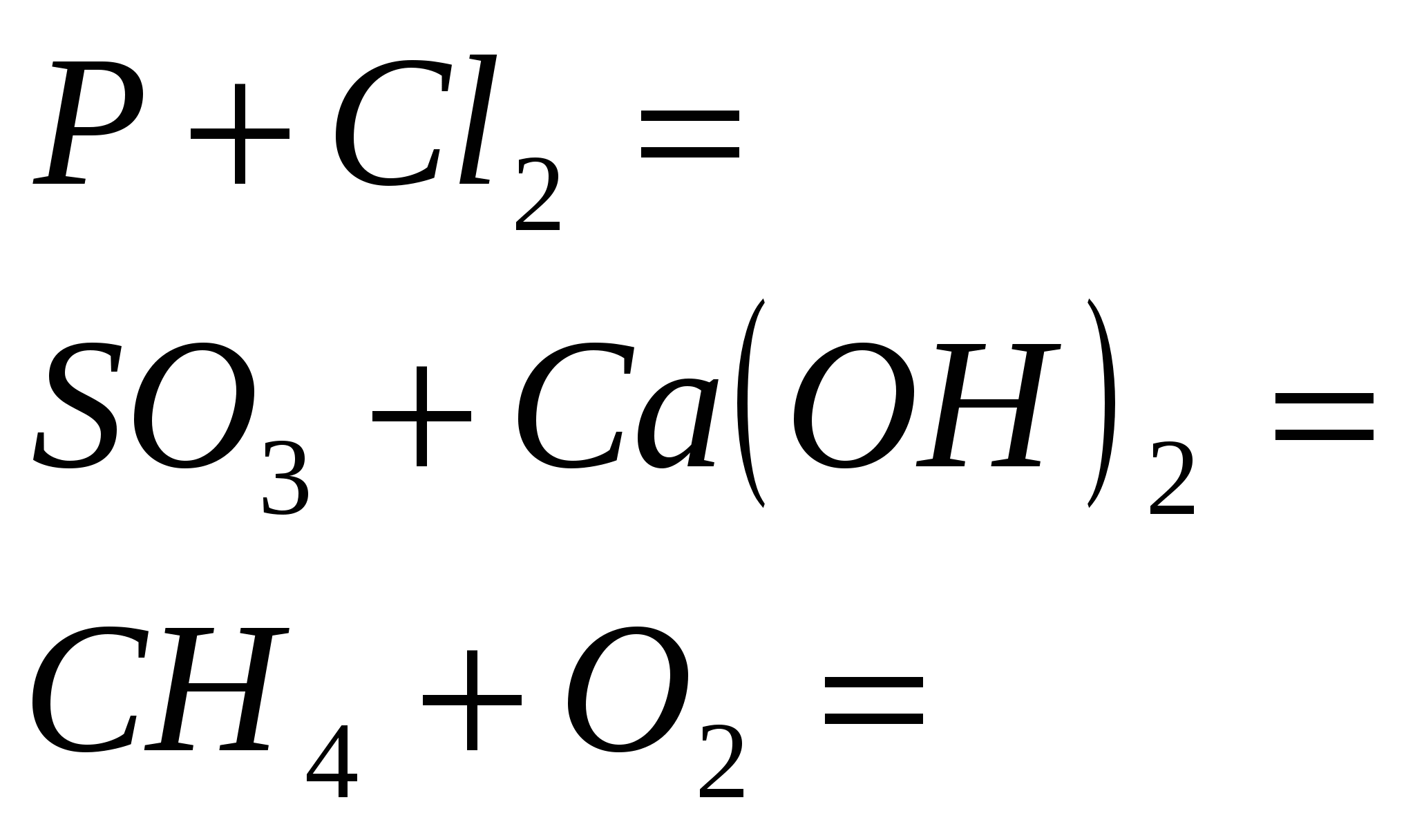
2.Закончите уравнение реакций
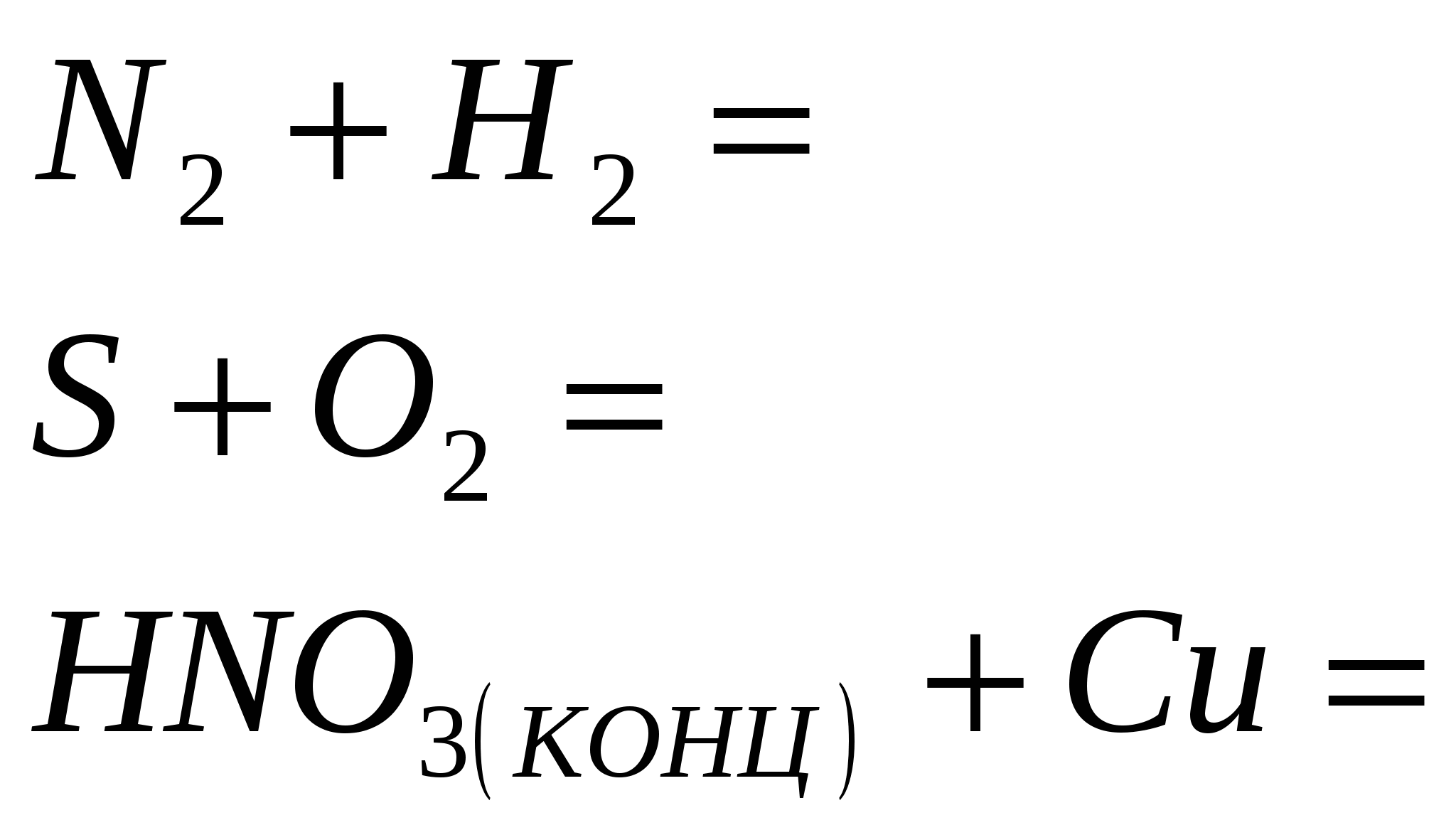
3.Закончите уравнения реакций
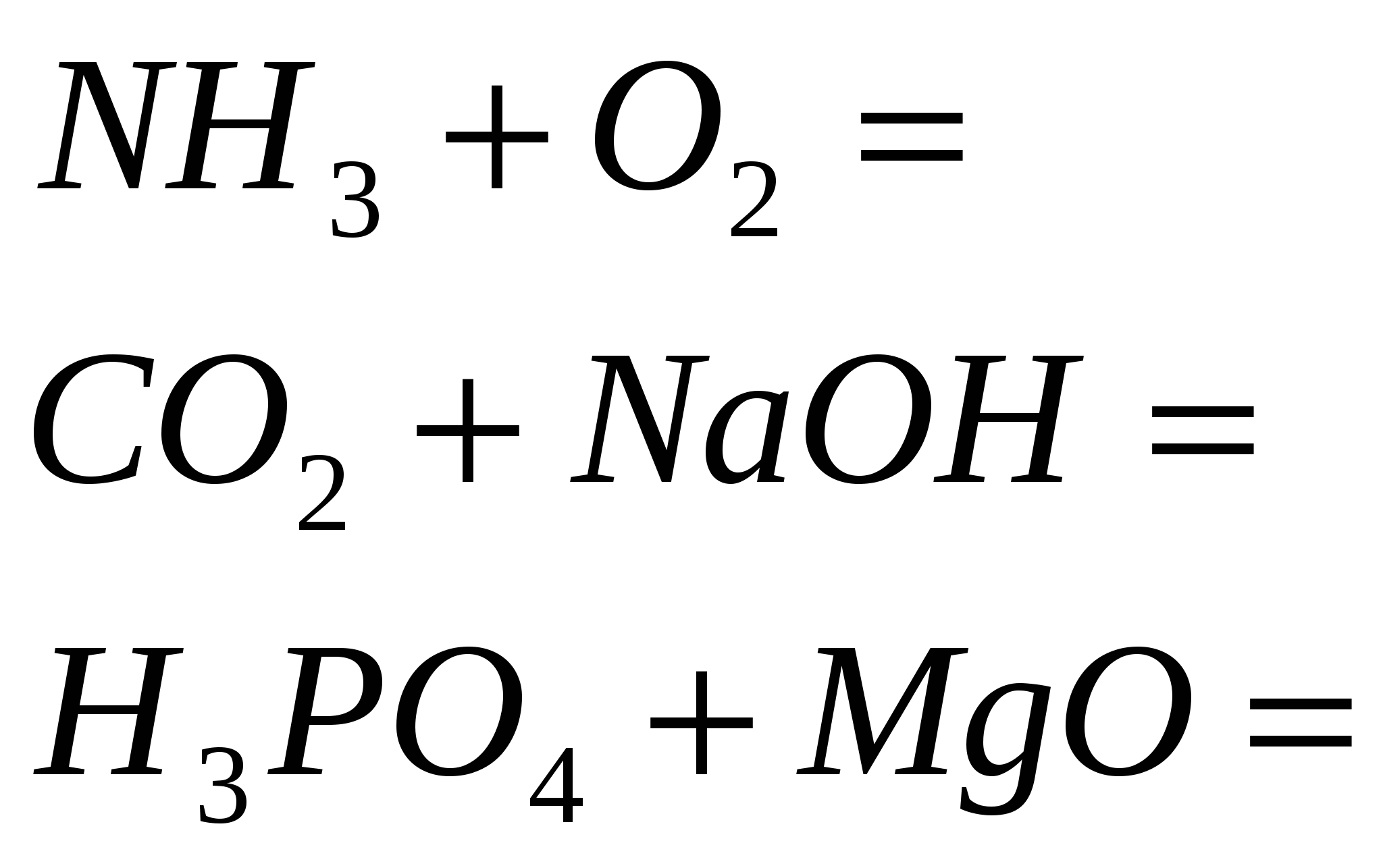
4. Закончите уравнения реакций
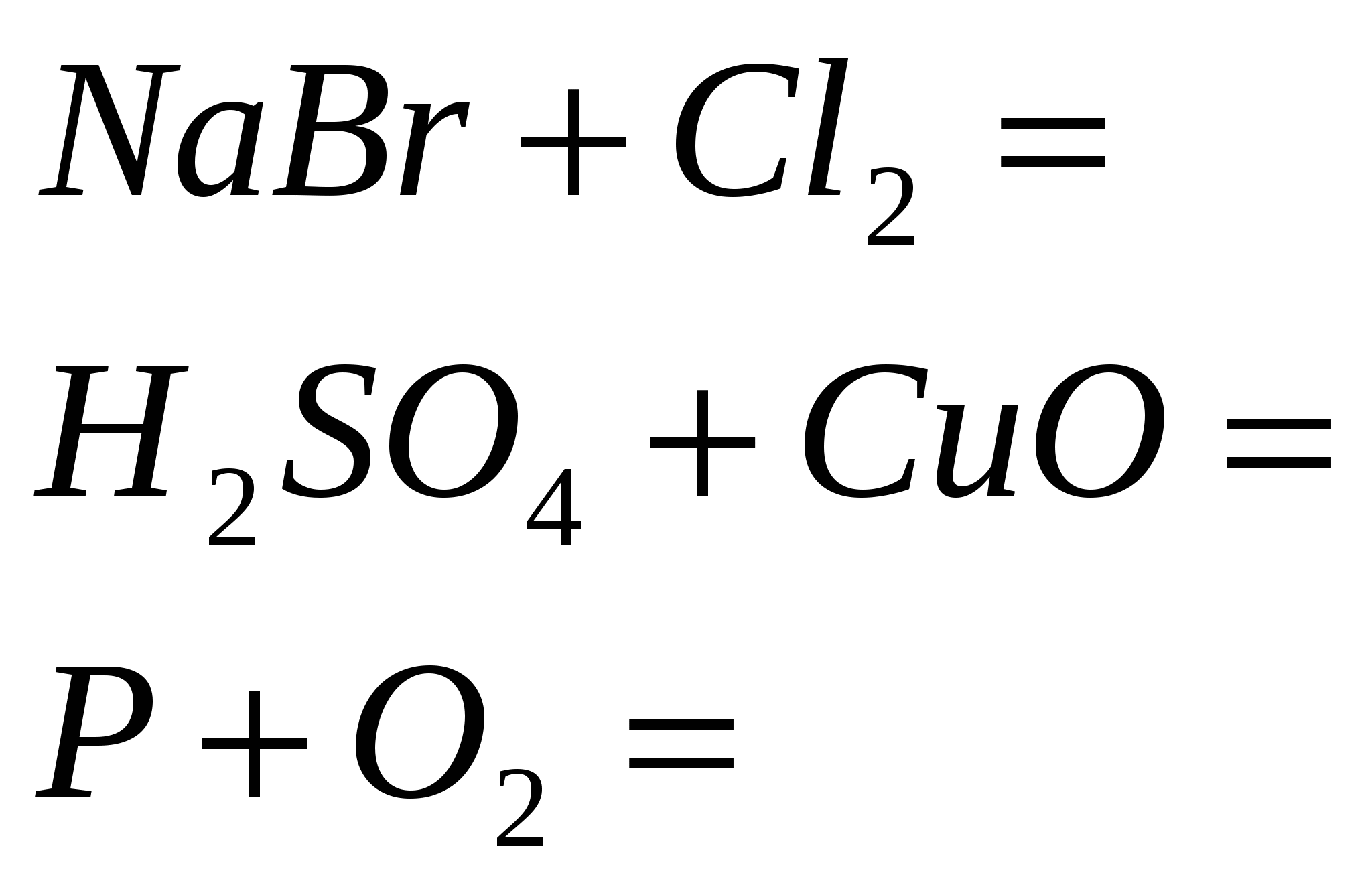
5. Закончите уравнения реакций

2 уровень
Осуществите превращения:
3 уровень
Осуществите превращения:
3.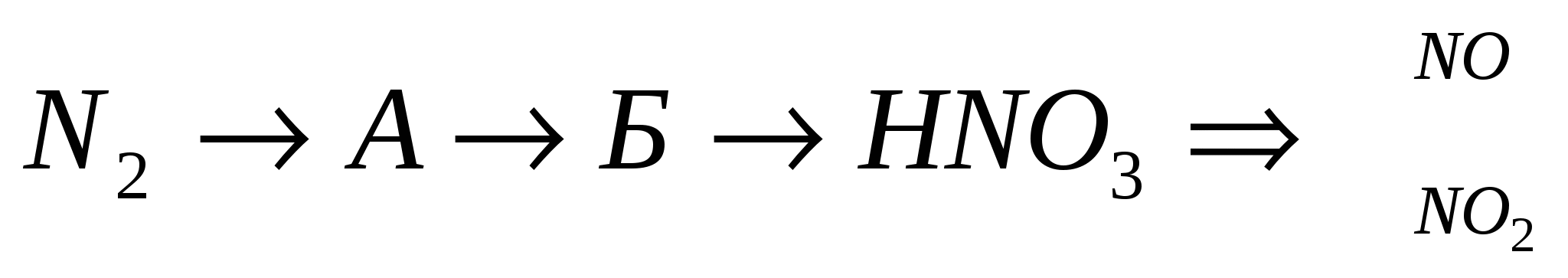
Этап «Тест»
Вариант 1
а) О, б) S , в) Cl , г) C , д) Si .
а)  , б) C
, в)
, б) C
, в)  , г)
, г)  , д)
, д) .
.
а) 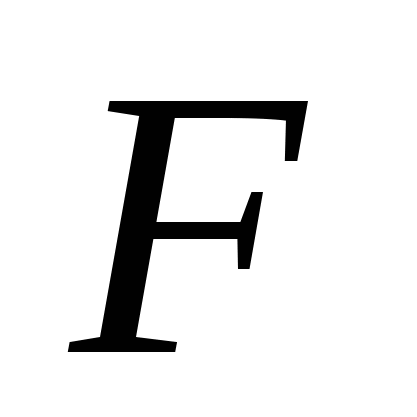 , б)
, б)  , в)
, в)  , г)
, г)  , д)
, д) 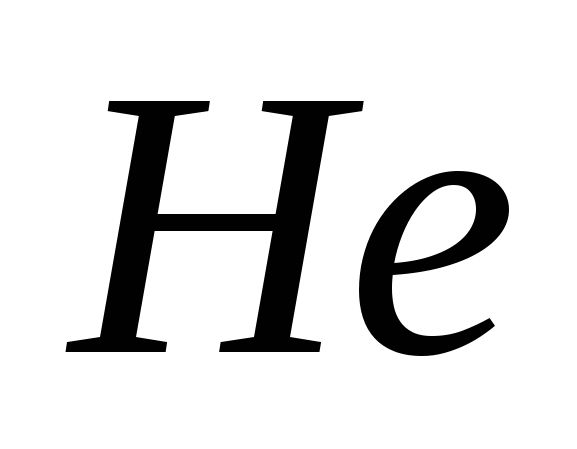 .
.
4.Электронная формула элемента. Его летучее водородное соединение:
а)  , б)
, б) 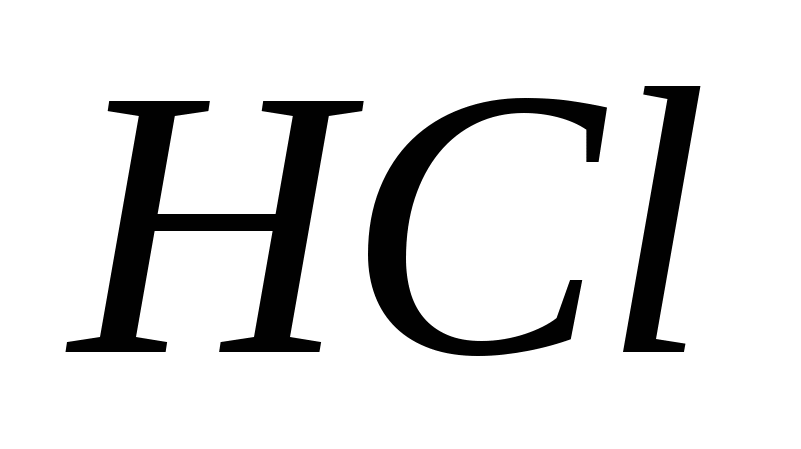 , в)
, в) , г)
, г)  .
.
5.Сила галогеноводородных кислот возрастает в ряду:
а)![]()
б)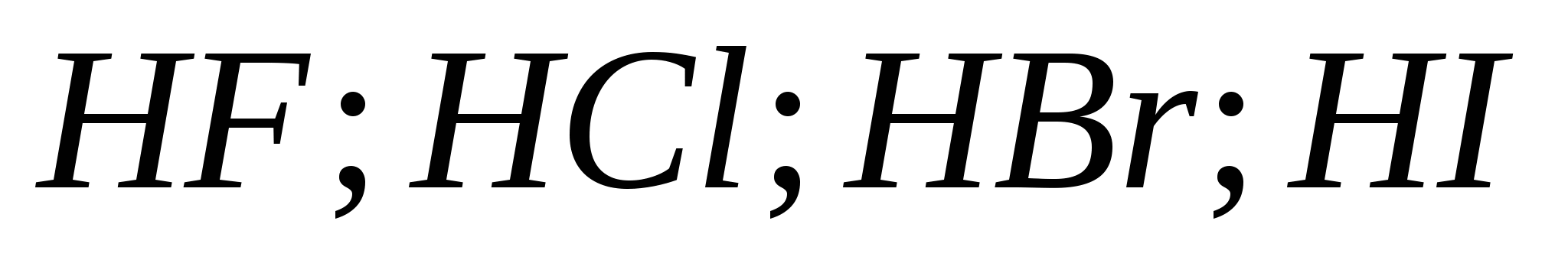
в)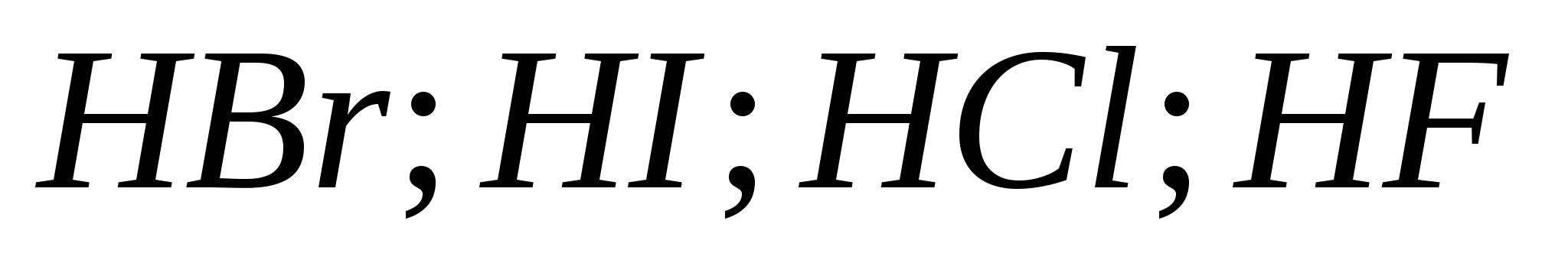
г)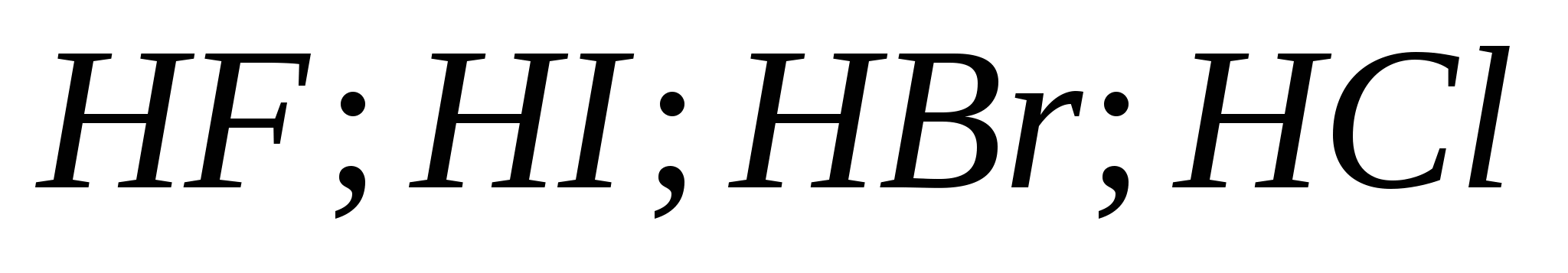
6. Из галогенов впервые в боевых действиях было применено вещество:
а) фтор, б) хлор, в) йод, г) бром.
7. Разбавленная серная кислота проявляет окислительные свойства за счёт атомов:
а) , б)
, б) , в)
, в)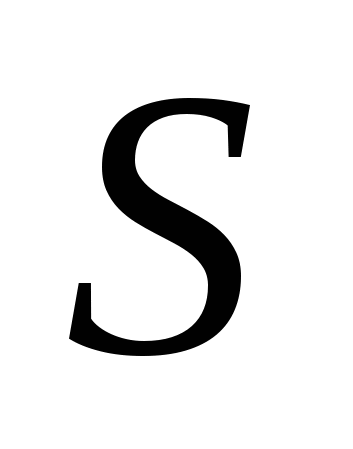 .
.
8.Оксид азота V может взаимодействовать:
а) 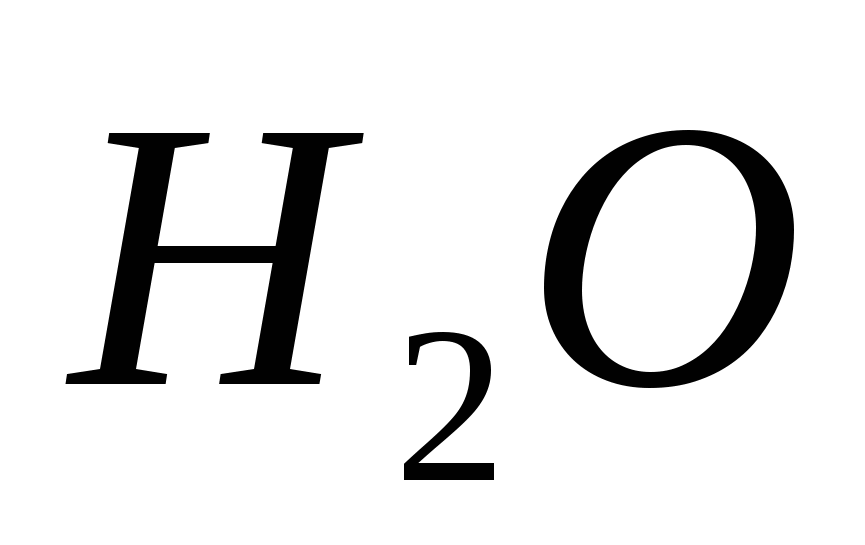 , б)
, б) 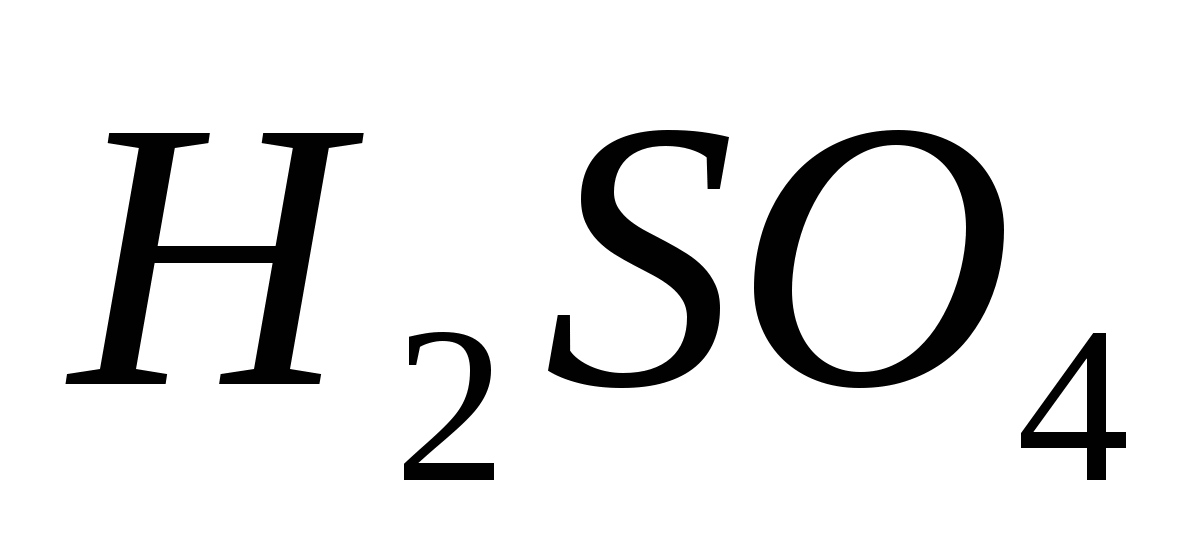 , в)
, в) , г)
, г)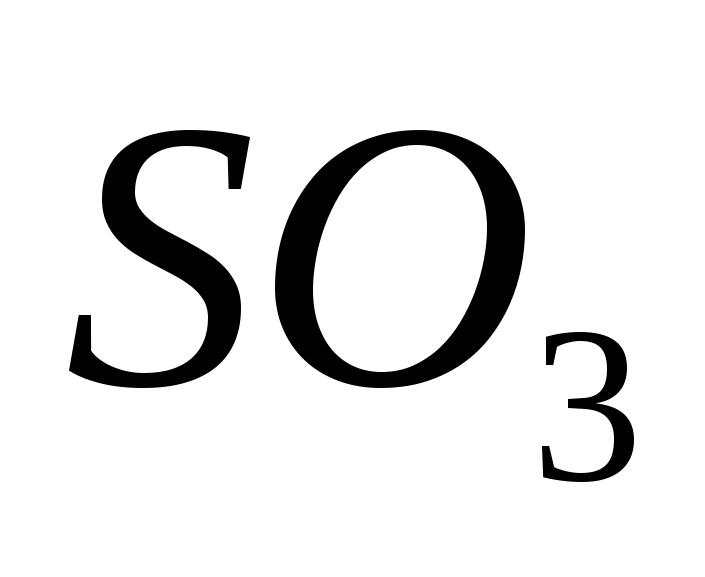 , д)
, д) .
.
9. Реакция: доказывает следующие свойства аммиака:
а) окислительные, б)восстановительные, в)кислотные, г)основные.
10. Сила кислот в ряду
а) уменьшается, б) увеличивается, в) сначала увеличивается, потом уменьшается, г) сначала падает, потом возрастает, д) не изменяется.
Вариант 2
Атомные кристаллические решетки имеют простые вещества, образованные:
а)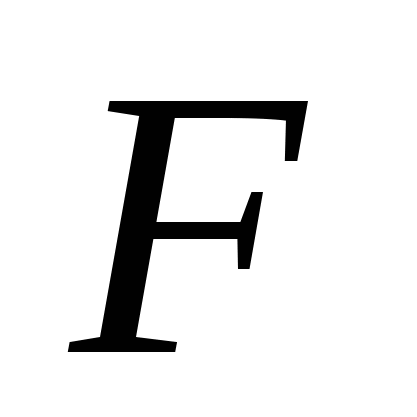 , б)
, б) , в)
, в)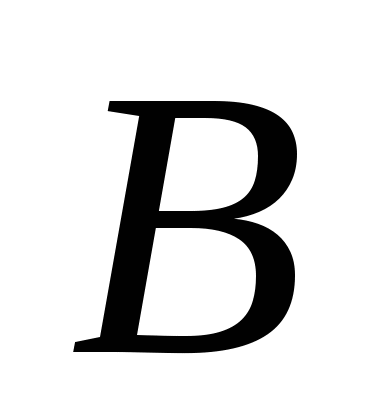 , г)
, г)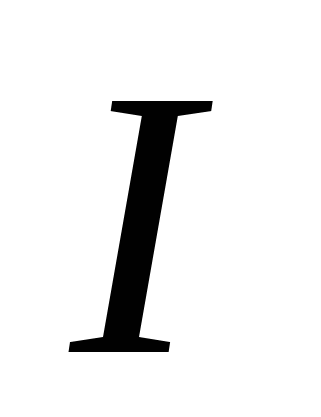 , д)
, д)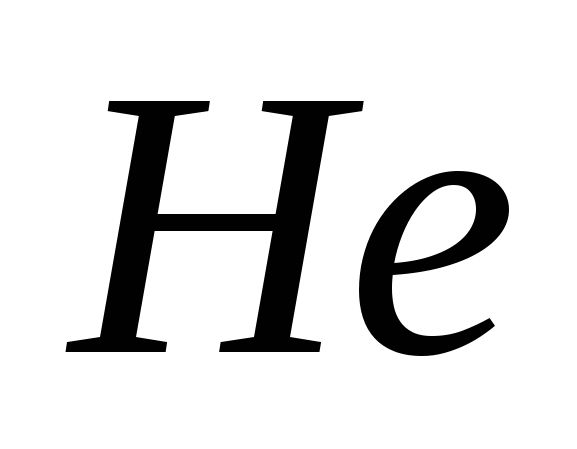 .
.
2. Газами при нормальных условиях являются:
а) 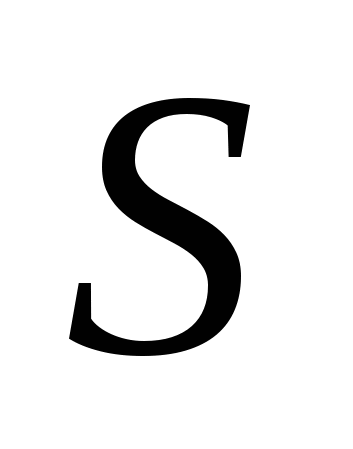 ,
б)
,
б) 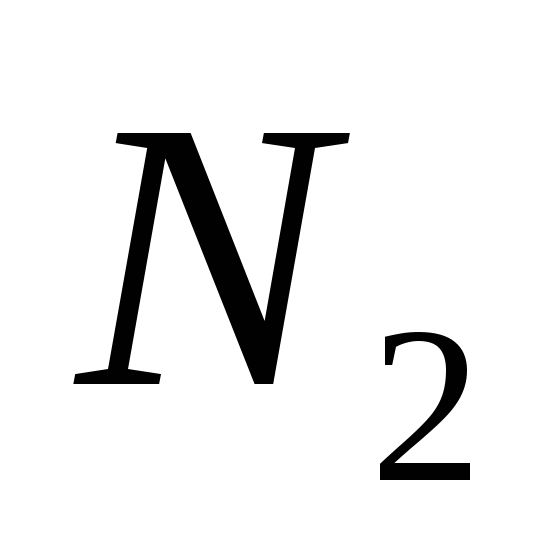 ,
в)
,
в)  ,
г)
,
г)  ,
д)
,
д) 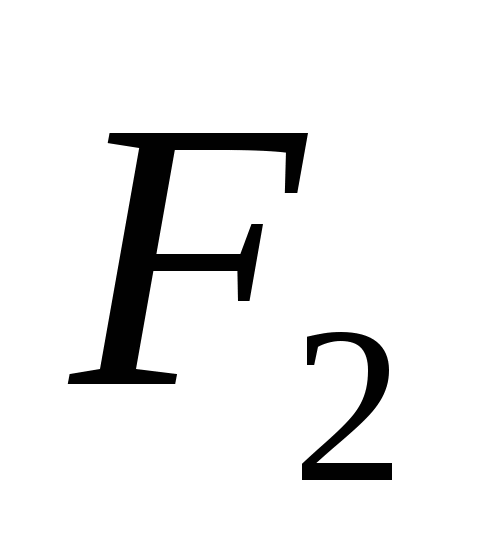 .
.
3. Аллотропные модификации образуют следующие элементы:
а)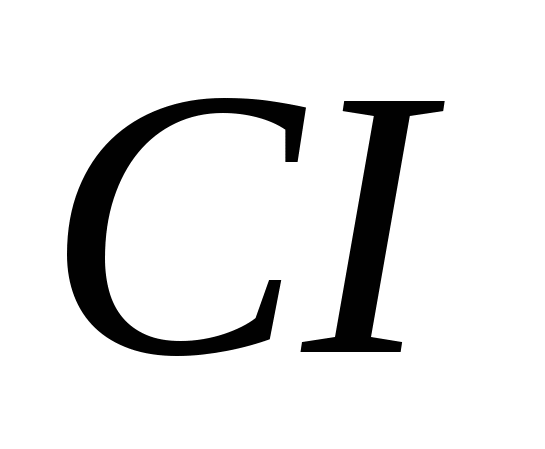 ,
б)
,
б)  ,
в)
,
в)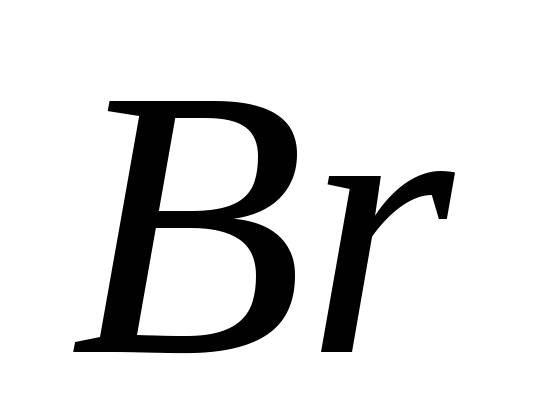 ,
г)
,
г) ,
д)
,
д)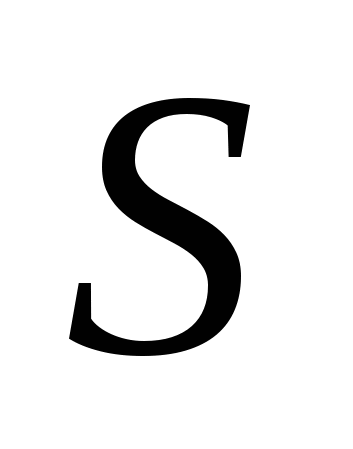 ,
,
4. Электронная формула элемента. Его летучее водородное соединение:
а) ,
б)
,
б)  ,
в)
,
в) ,
г)
,
г)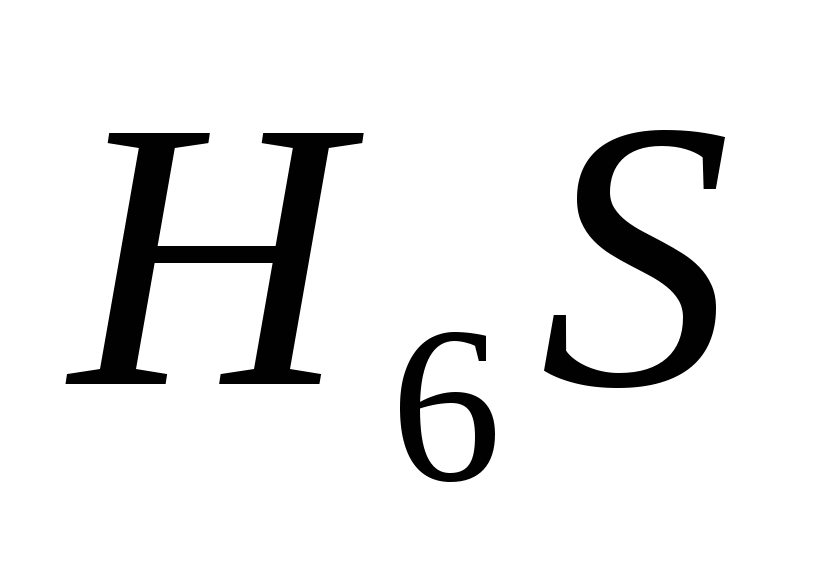 ,
д)
,
д) .
.
5. Основные свойства летучих водородных соединений убывает в ряду:
а)
б)
в)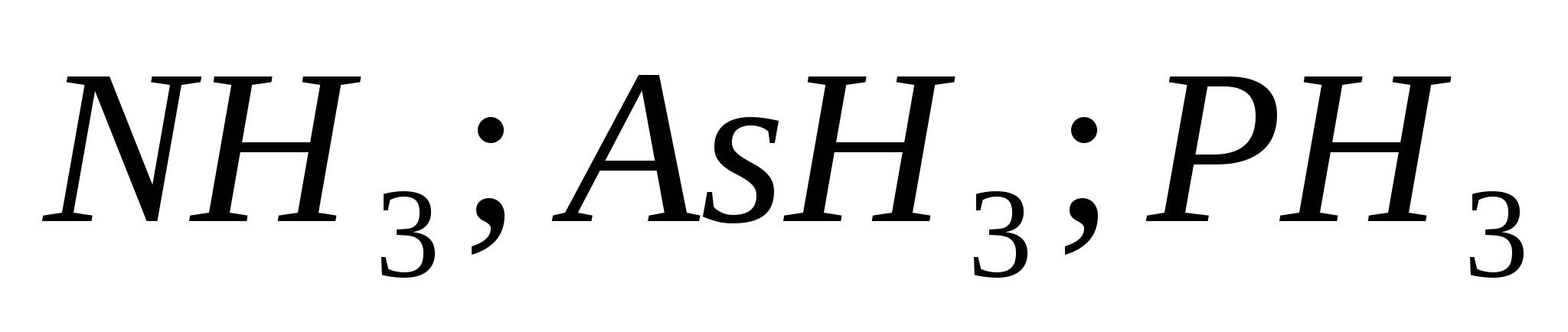
г)
6. Для поглощения хлора можно использовать концентрированные растворы:
а)  ,
б)
,
б) 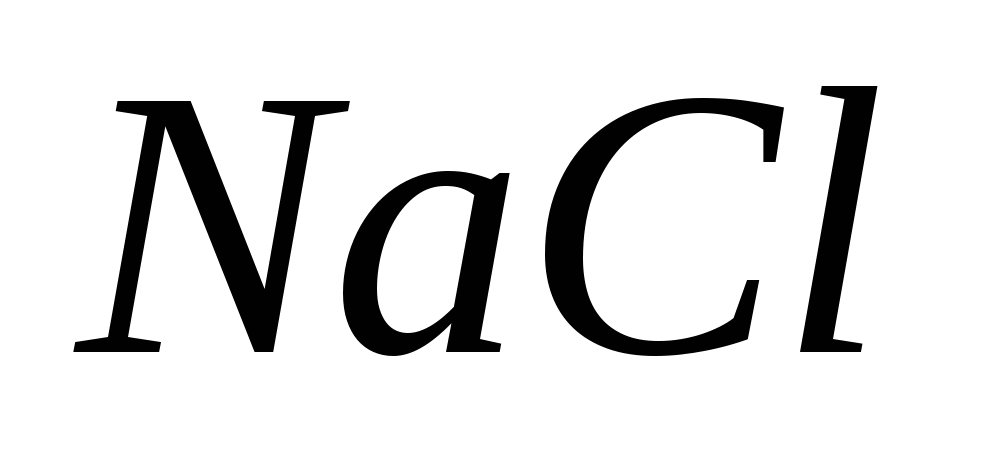 ,
в)
,
в) 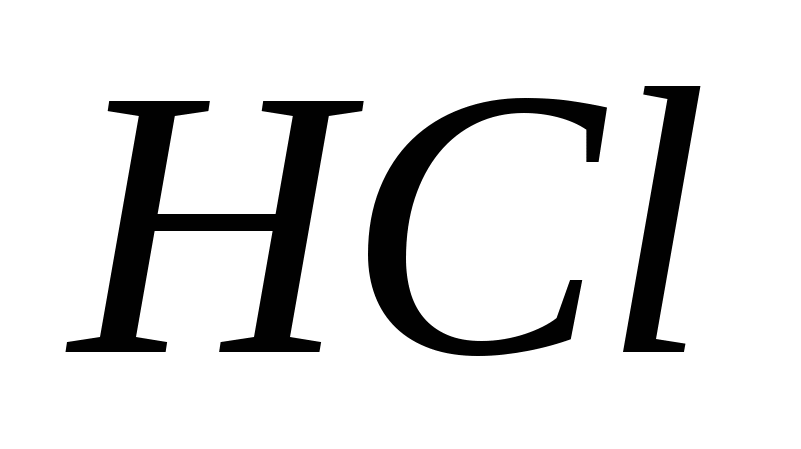 ,
г)
,
г) .
.
7. Концентрированная серная кислота проявляет окислительные свойства за счёт атомов:
а) , б)
, б) , в)
, в)  .
.
ПРИМЕЧАНИЕ:9-10 правильных ответов-«5»; 7-8-«4»; 5-6-«3»; менее 5-«2»
Этап «Теория»
I уровень (на «3»)
Напишите уравнения реакций, характеризующие свойства разбавленной серной кислоты.
Напишите уравнения реакций, характеризующие свойства оксида серы (VI ).
Напишите уравнения реакций, характеризующие свойства содяной кислоты.
Напишите уравнения реакций, характеризующие свойства оксида фосфора (V ).
Напишите уравнения реакций, характеризующие свойства аммиака.
II уровень (на «4»)
Запишите формулы летучих водородных соединений неметаллов II периода. Объясните, как и почему изменяются их кислотные свойства.
Запишите формулы высших оксидов неметаллов III периода. Объясните, как и почему изменяются их кислотные свойства.
Запишите формулы высших кислот элементов III периода. Объясните, как и почему изменяются их кислотные свойства.
Запишите формулы летучих водородных соединений неметаллов VI А подгруппы. Объясните, как и почему изменяются их кислотные свойства.
Запишите формулы высших кислот элементов VA подгруппы. Объясните, как и почему изменяются их кислотные свойства.
III уровень (на «5 »)
Сравните окислительные и кислотные свойства серной и азотной кислот. Ответ подтвердите уравнениями реакций.
Сравните окислительно-восстановительные и кислотные свойства оксида серы (IV ) и оксида углерода (IV ). Ответ подтвердите уравнениями реакций.
Сравните окислительные и кислотные свойства воды и фтороводорода. Ответ подтвердите уравнениями реакций.
Сравните окислительные и кислотные свойства концентрированной и разбавленной азотной кислоты. Ответ подтвердите уравнениями реакций.
Сравните окислительные и кислотные свойства оксида углерода (II ) и оксида углерода (IV ). Ответ подтвердите уравнениями реакций.
Этап «Расчётная задача»
I уровень (на «3»)
II уровень (на «4 »)
При взаимодействии 37г гидроксида кальция с сульфатом аммония было получено 15 г аммиака. Вычислите массовую долю выхода аммиака в %.
При сжигании в кислороде 62 г фосфора было получено 130 г оксида фосфора (V ). Вычислите массовую долю выхода оксида фосфора (V ) в %.
Сколько граммов 10% раствора гидроксида натрия понадобится для нейтрализации 8,96 л хлороводорода?
Сколько литров углекислого газа можно получить разложением 10 кг известняка, содержащего 20% примесей.
Сколько граммов осадка образуется при пропускании 11,2 л углекислого газа через 900 г 10% раствора гидроксида бария?
III уровень (на «5 »)
Какой объём 80%-ной азотной кислоты (пл. 1,46 г/мл) необходим для «растворения» 32 г меди?
Какая масса меди потребуется для реакции с избытком концентрированной азотной кислоты для получения 4 л (н.у.) оксида азота (IV ), если объёмная доля его выхода составляет 96%?
При «растворении» в концентрированной серной кислоте 20 г сплава золота с медью выделилось 4,2 л (н.у.) оксида серы (IV ). Определите массовую долю в % меди в этом сплаве.
Смесь газов хлора и водорода объёмом 1 л пропустили через раствор иодида калия. При этом выделилось 5,08 г йода. Определите объёмную долю (в %) газа хлора в исходной смеси.
Смесь кремния и угля массой 10 г обработали избытком концентрированного раствора гидроксида натрия. В результате реакции выделилось 5,6 л водорода (н.у). Определите массовую долю кремния (в %) в данной смеси.
Задания.
- Чем вызвано такое изменение окраски? На каком свойстве дихромата основано употребление хромовой смеси для мытья посуды?
- Налить в пробирку 5-6 капель дихромата калия и 3 капли раствора серной кислоты. Добавить 2 капли йодида калия и разбавить содержимое пробирки 10 каплями воды. Перенести пипеткой в другую пробирку часть содержимого и добавить каплю крахмала. Изменилась ли окраска крахмала? Почему? Составить уравнение ОВР и уравнять электронно-ионным методом.
- Общая характеристика элемента 15 Р. Свойства аллотропных модификаций фосфора. Взаимодействие фосфора с простыми и сложными веществами.
· В фармации оксид ртути (II) применяется как нежное антисептическое средство для приготовления глазных мазей, которое получают действием разбавленного раствора гидроксида натрия на растворимые соли ртути. Все операции проводят в темноте.
Задания.
1. Написать соответствующую реакцию получения оксида ртути (II). Объяснить, почему необходимо проводить операции в темноте?
3. Основные законы химии.
Использование соединений цинка в медицине основано на его вяжущем, антисептическом действии. 0,25% раствор сульфата цинка используется для изготовления глазных капель вместе с 2 % - ной борной кислотой.
Задания.
- Приготовить 0,25 % - ный раствор сульфата цинка объемом 100мл (ρ = 1,02 г/мл).
- Осуществить превращения
Zn→ ZnCl 2 →ZnSO 4 →Zn(NO 3) 2 →Zn(OH) 2 →Na 2 →NaCl
- Ковалентная связь, определение, виды, механизм образования, свойства. Валентность. Степень окисления.
· Фармацевт проводит контроль качества препарата железа методом перманганатометрии.
Задания.
1. Написать уравнение соответствующей реакции и уравнять его электронно - ионным методом.
2. Вычислить, какой объем 0,5% - ного (ρ = 1,004 г/мл) раствора гидроксида натрия потребуется для реакции с 0,1 М раствором хлорида железа (III) объемом 20мл.
3. Периодический закон и периодическая система в свете учения о строении атома.
· Железо, восстановленное, применяемое внутрь как противоанемическое средство, должно быть свободно от примесей сульфидов меди, угля, кремниевой кислоты, мышьяка.
Задания.
1. Предложить способ отделения железа от примесей. Обосновать ответ.
3. Основные виды химической связи. Природа образования химической связи.
· Для организма перманганаты являются ядами, их обезвреживание проводят с использованием 3% - го водного раствора Н 2 О 2 , подкисленной уксусной кислотой.
Задания.
1. Написать уравнение соответствующей реакции. Уравнять реакцию электронно- ионным методом
- Оксиды, определение, классификация, номенклатура, свойства и способы получения.
· Количественное определение вещества в препарате железа проводится методом перманганатометрии, основанным на способности Fe 2+ окисляться до Fe 3+ . Вначале навеску железа восстановленного растворяют в серной кислоте при нагревании и после охлаждения титруют 0,1 н раствором перманганата калия.
Задания.
1. Написать уравнения реакций, лежащих в основе количественного определения.
2. Приготовить 200мл раствора 0,1 н KMnO 4 (фактор эквивалентности определить по полуреакции).
3. Кислоты, определение, классификация, номенклатура, свойства, способы получения.
· Фармакопейный препарат нитрата серебра получают следующим образом: растворяют медно-серебряный сплав в разбавленной азотной кислоте, затем, чтобы очистить полученный нитрат от примесей, осаждают его хлороводородной кислотой. Получившийся осадок восстанавливают цинком в кислой среде, и серебро, освобожденное от примесей, снова растворяют в азотной кислоте.
Задания.
- Написать уравнения соответствующих реакций.
- Выполнить качественные реакции на Cl - , Br - , J анионы с раствором нитрата серебра, лежащих в основе подтверждения подлинности препаратов хлоридов, йодидов, бромидов калия.
- Основания, определение, классификация, номенклатура, свойства, способы получения.
· 9. Нитрат серебра применяется наружно при эрозиях, язвах, остром конъюнктивите в виде 2,5 и 10% водных растворов.
Задания.
- Приготовить 2% - ный раствор AgNO 3 объемом 50 мл (ρ= 1,015 г/мл). Какие условия хранения данного раствора необходимо соблюдать?
- Осуществить превращения
Ag→AgNO 3 →AgCl→ AgNO 3 →Ag
- Соли, определение, классификация, номенклатура, свойства, способы получения.
· Фармацевту предстоит провести идентификацию фармакопейного препарата сульфата бария.
Задания.
1. С какой целью используют сульфат бария в медицине? Почему сульфат бария перед проведением реакций идентификации сплавляют с карбонатом натрия? Ответ подтвердить уравнениями реакций.
2. Выполнить реакции идентификации солей BaSO 4 , CaSO 4 , Na 2 SO 4 .
3. Комплексные соединения, определение, строение по А.Вернеру, природа химической связи, классификация, номенклатура, диссоциация. Применение комплексных соединений в медицине и химическом анализе.
· Фармацевт при работе с концентрированным раствором аммиака допустил грубое нарушение техники безопасности – проводил работы в вытяжном шкафу без включенной тяги.
Задания.
- Какие последствия могут быть при работе с концентрированным раствором аммиака без соблюдения техники безопасности? Какую первую медицинскую помощь необходимо оказать при отравлении парами аммиака.
- Осуществить следующие превращения.
(NH 4) 3 PO 4 →NH 3 →NH 4 NO 2 →N 2 →NO→ NO 2 →HNO 3 →Hg(NO 3) 2 →NO 2
Написать уравнения реакций в молекулярном и ионном виде, а для ОВР – уравнять методом электронного баланса.
- Химическая кинетика. Скорость химической реакции. Влияние различных факторов на скорость химической реакции.
· Из соединений азота в медицине применяются раствор аммиака в воде, соли аммония, оксид диазота и нитрит натрия.
Задания.
- В каких целях используются данные соединения азота? Написать формулы данных веществ и уравнения реакций, характеризующие основные их свойства.
- Написать уравнение реакции взаимодействия нитрата натрия с перманганатом калия в кислой среде. Уравнять реакцию методом полуреакций
- Необратимые и обратимые химические реакции. Химическое равновесие. Закон действующих масс для равновесных систем. Константа равновесия. Принцип Ле Шателье.
· Фармацевту предстоит провести идентификацию солей сульфата натрия, хлорида натрия, гидрокарбоната натрия.
Задания.
- Выполнить качественные реакции на ионы SO 4 2- , Cl - , HCO 3 - .
- Рассчитать, сколько граммов кристаллогидрата Na 2 SO 4 ·10H 2 O необходимо фармацевту растворить в воде массой 500г, чтобы получить 5% - ный раствор Na 2 SO 4 ?
- Окислительно-восстановительные реакции. Основные положения электронной теории окислительно-восстановительных реакций. Важнейшие окислители и восстановители. Уравнивание окислительно-восстановительных реакций методом электронного баланса и ионно-электронным методом.
· Калиевая соль серной кислоты связывает многие чужеродные для организма препараты (ксенобиотики) – лекарственные препараты и их метаболиты с образованием относительно безвредных веществ – конъюгатов, которые легко выводятся из организма.
Задания.
- Получить калиевую соль серной кислоты различными способами, используя имеющиеся на столе реактивы. Написать уравнения соответствующих реакций.
- Составить молекулярные уравнения реакций, выражаемых следующими сокращенными ионными уравнениями:
S 2- + Н 2 S→ 2НS –
S 2- + 2Н + → Н 2 S
НS – + OH - → S 2– + H 2 O
· Дисперсные системы, определение, классификация. Суспензии, аэрозоли, эмульсии. Использование грубодисперсных систем в медицине и фармации.
Фармацевту необходимо получить 5%- ный раствор серной кислоты.
Задания.
- Зависит ли окислительная способность аниона SO 4 2- от концентрации кислоты? Написать уравнения реакций, характеризующие свойства разбавленной и концентрированной кислоты.
- Приготовить 5%- ный раствор серной кислоты, имея 50мл серной кислоты с массовой долей H 2 SO 4 30%.
- Коллоидные растворы, классификация, определение, молекулярно- кинетические и оптические свойства, получение. Устойчивость коллоидных растворов. Коагуляция. Пептизация. Строение мицелл. Диализ.
· Сера, входящая в состав аминокислот, окисляется в организме. Образующаяся при этом эндогенная серная кислота участвует в обезвреживании ядовитых соединений – фенола, крезола, индола.
Задания.
- Описать свойства серной кислоты и перечислить правила работы с кислотами.
- Рассчитать, какой объем серной кислоты с массовой долей H 2 SO 4 25% и плотностью 1,18 г/мл необходимо взять для нейтрализации гидроксида калия, объемом 50 мл, с массовой долей КОН 12 % и плотностью 1,1г/мл.
- Истинные растворы, определение, основные понятия, сущность процесса растворения. Диффузия. Осмос. Осмотическое давление.
· В промышленных районах, где сжигается много угля, нередко выпадают кислотные дожди.
Задания.
- Что представляет собой по химическому составу кислотный дождь в данных районах? Как он образуется? Написать уравнения реакций.
- Составить молекулярные и сокращенные ионные уравнения гидролиза следующих солей:
K 2 S, Na 2 SO 4 , Na 2 SO 3 , Al 2 (SO 4) 3 , Cr 2 S 3
· Сероводород образуется в природе в больших количествах за счет биохимических процессов и содержится в так называемых серных минеральных водах.
Задания.
- Свойства сероводорода.
- Осуществить превращения:
H 2 S→SO 2 →H 2 SO 3 →NaHSO 3 →Na 2 SO 3
Написать уравнения реакций в молекулярном и ионном виде.
- Диссоциация кислот, оснований, солей, воды. Кислотно-основное равновесие в растворах. Ионное произведение воды, рН- растворов.
· Официальным лекарственным препаратом серы является сера, осажденная (Sulfur praecipitafum).
Задания.
- Описать свойства свободной серы и аллотропных модификаций серы.
- Осуществить превращения:
Уравнять реакции методом электронного баланса.
- Гидролиз. Сущность процесса гидролиза. Гидролиз различных типов солей. Степень гидролиза. Влияние различных факторов на степень гидролиза.
· Фармацевт проводит реакцию идентификации 3% раствора перекиси водорода: к 1 мл исследуемого раствора прибавляет 1 мл разбавленной серной кислоты, 1 мл эфира и 0,5 мл раствора дихромата калия, в результате слой эфира окрашивается в синий цвет вследствие образования надхромовой кислоты H 2 CrO 6
Задания.
- Выполнить реакцию идентификации перекиси водорода.
- Написать уравнения идентификации раствора перекиси водорода и уравнять методом электронного баланса.
- Общая характеристика элементов главной подгруппы VII группы и их соединений. Медико-биологическое значение галогенов.
· Кислород является фармацевтическим препаратом и описан в ГФ. Его применяют для вдыхания при различных типах кислородного голодания.
20. Задания .
- Написать уравнения реакций обнаружения примесей СО, СО 2 , NO, NO 2 .
- Написать уравнения реакций, лежащих в основе лабораторного способа получения кислорода. Уравнять приведенные реакции методом электронного баланса
- Хлор, хлороводород, соляная кислота, хлориды. Физические и химические свойства хлора и его соединений. Медико- биологическое значение галогенов.
· Фармацевт проверяет подлинность препаратов на основе хлорида натрия, бромида натрия и йодида натрия.
Задания.
- Для каких целей используют данные соли в фармации и медицине.
- Выполнить качественные реакции на анионы Cl - , Br - , J - .
- Физические и химические свойства кислородных соединений хлора. Получение. Применение.
· Одним из промышленных способов получения йода для фармации является процесс выделения йода из буровых вод. Йодиды, находящиеся в буровых водах, окисляют по схеме:
NaJ + NaNO 2 + H 2 SO 4 →J 2 +Na 2 SO 4 +NO+ H 2 O
22. Задания .
- Какие препараты йода и в каких целях применяются в медицине.
- Уравнять реакцию, лежащую в основе получения йода методом полуреакции.
- Общая характеристика халькогенов. Свойства кислорода и его соединений. Медико-биологическое значение кислорода.
· Фармацевт определяет подлинность препаратов хлоридов натрия, калия и кальция.
Задания.
- Для каких целей используют данные фармацевтические препараты.
- Выполнить реакции идентификации данных солей.
- Соединения кислорода с водородом. Физические и химические свойства воды. Пероксид водорода, свойства, применение в медицине. Значение воды в жизнедеятельности организмов.
· Из соединений галогенов с кислородом лишь гипохлориты представляют интерес для медицины в качестве дезинфицирующих средств.
Задания.
- На каком свойстве гипохлоритов основано их дезинфицирующее действие? Написать уравнения соответствующих реакций.
- Рассчитать, сколько граммов хлорной извести необходимо взять для получения 2 л активного хлора.
- Сера и ее соединения. Аллотропия свободной серы. Физические и химические свойства серы, сероводорода, сероводородной кислоты и ее солей.
· При недостаточной кислотности желудочного сока назначают внутрь разведенную хлороводородную кислоту.
Задания.
- Перечислить общие правила работы с кислотами.
- Рассчитать, сколько миллилитров 36,5% - ного раствора (ρ=1,19г/мл) соляной кислоты необходимо взять для приготовления 100мл. 8,2% - ой (ρ=1,040 г/мл) кислоты.
- Физические и химические свойства оксидов серы, сернистой кислоты, серной кислоты. Сульфиты. Сульфаты. Свойства, получение, применение.
· В фармации одним из стандартных растворов является раствор, содержащий 33% ацетата калия, который получают путем растворения карбоната калия в 30% - ом растворе уксусной кислоты.
Задания.
1. Написать уравнения реакции в молекулярном и ионном виде.
- Общая характеристика элементов главной подгруппы V группы. Свойства свободного азота. Значение азота в жизнедеятельности организмов.
· Прописан раствор вещества, являющегося солью сильного основания и слабой кислоты. По указанию ГФХ в качестве стабилизатора добавляется 0,1 н раствор едкого натра из расчета 4 мл на 1 литр раствора.
Задания.
- Написать уравнение реакции гидролиза соли CH 3 COONa.
- Рассчитать, сколько граммов NaOН необходимо взвесить, чтобы получить 500мл 0,1 н раствора. Приготовит данный раствор с соблюдением техники безопасности.
- Аммиак. Соли аммония. Свойства. Применение в медицине и фармации.
· Фармацевт готовит по рецепту защитную мазь: 1 г карбоната калия и 0,5 г тетрабората натрия растворяет в 70 мл дистиллированной воды, 10 г стеарина сплавляет с 15 г вазелинового масла и тонкой струей при помешивании добавляет в теплый водный раствор карбоната калия и натрий тетрабората.
Задания.
- Какие вещества образуются в результате данного смешивания? Какая среда при этом образуется и почему? Ответ подтвердить уравнениями реакций.
- Подготовить техно-химические весы к работе. Взвесить 1 г карбоната калия на техно-химических весах.
- Оксиды азота. Азотистая кислота и ее соли. Физические и химические свойства. Медико-биологическое значение соединений азота.
· Фармацевту необходимо приготовить 0,05% раствор калия перманганата объемом 200мл для полоскания полости рта и горла.
Задания.
- На каком свойстве перманганата калия основано его лечебное действие? Какие соединения марганца применяются в лечебных целях?
- Рассчитать, сколько граммов KMnO 4 необходимо взвесить для получения 200мл 0,05 % раствора KMnO 4 (ρ= 0,9994 г/мл.). Продемонстрировать технику приготовления данного раствора.
- Строение молекул азотной кислоты. Физические и химические свойства азотной кислоты и ее солей. Медико – биологическое значение азота и его соединений.
· В фармации оксид ртути (II), используемый в качестве антисептического средства, получают действием разбавленного раствора гидроксида натрия на растворимые соли ртути(II).
Задания.
1. Написать соответствующую реакцию получения оксида ртути (II). Почему реакции необходимо проводить в темноте?
3. Основные законы химии.
K 2 Cr 2 O 7 +H 2 O 2 +H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 +H 2 O
Образующаяся при этом надхромовая кислота H 2 CrO 6 представляет собой соединение синего цвета. Синяя окраска кислоты подтверждает подлинность препарата Н 2 О 2.
Задания.
- Уравнять данную реакцию электронно-ионным методом.
- Какие соединения хрома будут проявлять окислительные свойства, а какие - восстановительные?
- Свойства фосфина, оксидов фосфора и фосфорных кислот, их получение. Медико-биологическое значение фосфора.
· Смесь оксида магния (85%) и пероксида магния (15%) является препаратом, известным под названием «магний перекись», который применяют при желудочно-кишечных расстройствах.
Задания.
- Объяснить антацидное и бактерицидное действие препарата. Ответ подтвердить уравнениями реакций.
- Рассчитать, сколько граммов MgO и MgO 2 вам необходимо взять для приготовления 100г данного препарата. Взвесить на техно-химических весах 10 г оксида магния.
- Общая характеристика элементов IV группы главной подгруппы. Строение, физические свойства аллотропов углерода. Химические свойства свободного углерода.
· Растворы гидрокарбоната натрия (питьевой соды) применяют в виде полосканий, промываний при воспалительных заболеваниях глаз, слизистых оболочек верхних дыхательных путей.
Задания.
- На каком свойстве гидрокарбоната натрия основано его антисептическое действие? Ответ подтвердить уравнениями реакций. Можно ли использовать в качестве антисептического средства тетраборат натрия Na 2 B 4 O 7 ∙ 10Н 2 О?
- Приготовить 5% раствор NaHCO 3 объемом 50мл (ρ =1,036г/мл).
- Строение молекул, физико-химические свойства кислородных соединений углерода. Медико - биологическое значение углерода и его соединений.
· Антацидные препараты, содержащие гидрокарбонат натрия, используют при различных заболеваниях, сопровождающихся повышенной кислотностью, т.е. ацидозом.
Задания.
- На каком свойстве данной соли основано действие антацидных препаратов? Ответ подтвердить уравнениями реакций. Какие другие вещества могут быть использованы для данных целей?
- Осуществить превращения:
NaOH→NaHCO 3 →Na 2 CO 3 →NaCl→NaNO 3
Написать уравнения реакций в молекулярном и ионном виде.
Выполнить реакции Na 2 CO 3 →NaCl→NaNO 3.
- Кремний и его соединения, нахождение в природе, получение, физические и химические свойства. Медико - биологическое значение кремния.
· 2,5%- ный раствор NaCl назначают внутрь для промывания желудка при отравлении AgNO 3 .
Задания.
1. На чем основано действие раствора NaCl? Ответ подтвердить уравнениями реакций.
3. Общая характеристика элементов главной подгруппы III группы. Свойства бора и его соединений. Медико- биологическое значение в медицине.
· Для разведения жидких лекарственных форм, предназначенных для инъекций, используют изотонический раствор.
Задания.
1. Что представляет собой изотонический раствор? Почему его называют изотоническим?
3. Алюминий и его соединения, свойства, получение. Медико-биологическое значение алюминия.
· 3%-ный водный раствор перекиси водорода применяют как наружное бактерицидное средство.
Задания.
1. На чем основано бактерицидное и кровоостанавливающее действие перекиси водорода. Какие меры предосторожности необходимо соблюдать при работе с пергидролем?
2. Рассчитать, сколько мл. пергидроля (30%-ный водный раствор Н 2 О 2, ρ= 1,1 г/мл) необходимо взять для получения 500 мл 3% - го раствора (ρ= 1,005г/мл). Приготовить данный раствор с соблюдением техники безопасности.
3. Металлы главной подгруппы II группы. Общая характеристика, получение, физические и химические свойства. Соли кальция и магния. Жесткость воды. Устранение жесткости воды. Медико-биологическое значение элементов главной подгруппы II группы.
· Современная фармацевтическая промышленность выпускает лекарственные препараты по агрегатному состоянию, типу дисперсных систем, способу введения в организм.
Задания.
1. Какие системы называются дисперсными?
Как классифицируются дисперсные системы?
В виде каких дисперсных систем выпускаются лекарственные препараты? Привести конкретные примеры.
- Получить гидрозоль канифоли методом замены растворителя.
- Общая характеристика щелочных металлов, получение, физико-химические свойства. Важнейшие соединения щелочных металлов. Медико-биологическое значение щелочных металлов.
· В виде водных растворов различных веществ обычно применяются жидкие лекарственные формы, обладающие полной взаимной растворимостью.
Задания.
- Истинные растворы, растворимость, насыщенный, ненасыщенный, перенасыщенный раствор. От каких факторов зависит растворимость веществ?
- Приготовить 5%-ный раствор CuSO 4 объемом 100мл (ρ= 1,051г/мл) из медного купороса CuSO 4 ∙5H 2 O
- Общая характеристика d - элементов. Металлы побочной подгруппы I группы и их соединениям. Медико- биологическое значение.
· В России используется электрообработка сочного и малосочного свежего растительного и животного сырья: ягод, плодов, корнеплодов овощей, различных органов животных с целью выделения соков (внутриклеточного содержимого) в нативном виде. Внутриклеточное содержимое представляет собой коллоидные растворы белков, нуклеиновых кислот, углеводов, дубильных веществ.
Задания.
1. Какие растворы называются коллоидными растворами? Как они классифицируются? Перечислить свойства коллоидных растворов. Какой процесс лежит в основе выделения соков из растительного сырья?
2. Получить гидрозоль гидроксида железа (III) методом гидролиза FeCl 3. Написать схему строения мицеллы.
- Металлы побочной подгруппы II группы, общая характеристика, строение, физические и химические свойства. Медико-биологическое значение.
· При изготовлении таблеток на основе экстракта валерианового корня не рекомендуется использовать магния карбонат как основной наполнитель, так как он может вызвать нейтрализацию изовалериановой кислоты и разрушение валтратов - веществ, очень чувствительных к воздействию щелочей и кислот.
Задания.
1. Объяснить проявление щелочных свойств карбоната магния. Написать уравнения реакции в молекулярном и ионном виде. Какие наполнители могут быть использованы для приготовления таблеток с экстрактом валерианы?
2. Осуществить превращения:
MgO→MgCl 2 →MgSO 4 →Mg(OH) 2 →MgOHCl
Написать уравнения реакций в молекулярном и ионном виде.
3. Общая характеристика элементов VI,VII групп побочных подгрупп. Окислительно- восстановительные свойства хрома, марганца и их соединений. Медико- биологическое значение.
· Сжиженный углекислый газ используют в фармацевтическом производстве для извлечения биологически активных веществ из лекарственного растительного сырья.
Задания.
- На каких свойствах углекислого газа основано применение его в данных целях?
- Осуществить превращения:
C→CH 4 →CO→CO 2 →BaCO 3 →Ba(HCO 3) 2 → BaCO 3 → CO 2
Реакции ионного обмена написать в молекулярном и ионном виде.
- Общая характеристика элементов VIII группы побочной подгруппы. Свойства железа и его соединений. Медико-биологическое значение.
Список экзаменационных вопросов по дисциплине
Основные понятия и законы химии. Современные представления о строении атома.
Периодический закон и периодическая система Д.И. Менделеева в свете учения строении атома.
Определение, виды, условия образования, природа химической связи.
Определение, механизм образования, свойства ковалентной связи. Валентность. Степень окисления.
Оксиды: определение, классификация, номенклатура, свойства и способы получения.
Кислоты: определение, классификация, номенклатура, свойства и способы получения.
Основания: определение, классификация, номенклатура, свойства и способы получения.
Соли: определение, классификация, номенклатура, свойства и способы получения.
Комплексные соединения: определение, строение по А.Вернеру, типы, номенклатура.
Скорость химической реакции. Факторы, влияющие на скорость химической реакции.
Необратимые и обратимые химические реакции. Химическое равновесие. Принцип М. Шателье. Константа равновесия.
Окислительно-восстановительные реакции: определение, основные понятия, сущность окисления и восстановления, важнейшие окислители и восстановители реакции.
Дисперсные системы: определение, классификация. Грубодисперсные системы: суспензии, аэрозоли, эмульсии.
Коллоидные растворы: определение, свойства, получение, строение мицелл.
Истинные растворы: определение, основные понятия, сущность процесса растворения. Диффузия. Осмос. Осмотическое давление.
Основные положения теории электролитической диссоциации. Механизм электролитической диссоциации. Степень и константа диссоциации.
Диссоциация кислот, оснований, солей. Диссоциация воды рН- растворов.
Сущность гидролиза. Гидролиз различных типов солей. Степень гидролиза.
Общая характеристика элементов главной подгруппы VII группы. Медико-биологическое значение галогенов.
Хлор, хлороводород и соляная кислота. Получение, свойства. Хлориды.
Кислородные соединения хлора.
Общая характеристика халькогенов. Кислород и его соединения. Медико-биологическое значение кислорода.
Свойства соединений кислорода с водородом (вода, пероксид водорода). Применение Н 2 О 2 в медицине. Значение воды.
Сера. Аллотропия свободной серы. Химические свойства серы. Сероводород. Сероводородная кислота и ее соли.
Физические и химические свойства оксидов серы, сернистой и серной кислот, солей сернистой, серной кислот, их применение.
Общая характеристика элементов главной подгруппы V группы. Азот и его свойства.
Свойства аммиака и солей аммония. Применение в медицине и фармации.
Оксиды азота. Азотистая кислота и ее соли. Физические и химические свойства, применение.
Физические и химические свойства азотной кислоты. Нитраты. Медико – биологическое значение азота и его соединений.
Характеристика элемента 15 Р. Свободный фосфор: аллотропия, физические и химические свойства, получение.
Фосфин. Оксиды фосфора и фосфорные кислоты: свойства, получение. Медико-биологическое значение фосфора.
Общая характеристика элементов IV группы главной подгруппы. Углерод: строение и физические свойства аллотропов углерода, химические свойства.
Кислородные соединения углерода: строение молекул, физические и химические свойства. Медико- биологическое значение углерода и его соединений.
Кремний и его соединения: нахождение в природе, получение, физические и химические свойства. Медико - биологическое значение кремния.
Главная подгруппа III группы: общая характеристика элементов. Бор и его соединения: получение, физические и химические свойства, применение в медицине.
Алюминий и его соединения: получение, физические и химические свойства. Медико-биологическое значение алюминия.
Металлы главной подгруппы II группы: общая характеристика, получение, физические и химические свойства. Соли кальция и магния. Жесткость воды. Устранение жесткости воды. Медико-биологическое значение элементов главной подгруппы II группы.
Щелочные металлы: общая характеристика, получение, свойства, важнейшие соединения. Медико-биологическое значение.
Общая характеристика d- элементов. Металлы побочной подгруппы I группы. Соединения меди, серебра. Медико- биологическое значение.
Металлы побочной подгруппы II группы: общая характеристика строения, физические и химические свойства. Медико- биологическое значение.
Побочные подгруппы VI,VII группы: общая характеристика элементов подгруппы, свойства хрома, марганца и их соединений. Медико- биологическое значение.
Побочная подгруппа VIII группы: общая характеристика элементов подгруппы, свойства железа и его соединений. Медико-биологическое значение.
Почернение поверхности старых картин, написанных масляными красками, в состав которых входят свинцовые белила (PbCO3 ), связано с образованием чёрного сульфида свинца(II) из-за наличия сероводорода в атмосфере. Если обработать почерневшую поверхность пероксидом водорода, то происходит реакция образования сульфата свинца(II) белого цвета:
PbS + 4H2 O2 = PbSO4 + 4H2 O.
Таким способом реставрируют почерневшие старые картины, написанные масляными красками.
Применение кислорода и серы
Области применения кислорода представлены на рисунке 61. Способностьозона разлагаться с образование атомарного кислорода по-
зволяет использовать его для обеззараживания питьевой воды и обезвреживания промышленных сточных вод; как дезинфицирующее средство в медицине. Используется озон и в качестве отбеливающего средства.
Серу используют для производства серной кислоты, изготовления спичек, бенгальских огней, для борьбы с вредителями сельского хозяйства, а также для лечения некоторых болезней. Сера находит применение при производстве резины, красителей и пигментов, искусственных волокон, люминофоров и др.
Рис. 61. Применение кислорода

Для кислорода в соединениях с другими элементами наиболее характерна степень окисления –2, атомы серы, селена и теллура проявляют степени окисления –2, +2, +4 и +6.
Окислительные свойства кислорода и серы проявляются в их реакциях с металлами, водородом и некоторыми другими неметаллами.
Вопросы и задания
1. Составьте формулы соединений кислорода с калием, кальцием и алюминием. Укажите степени окисления каждого элемента и назовите соединения.
2. Рассчитайте массовую долю серы в сульфиде алюминия.
3. Название «кислород» - oxygenium означает «рождающий кислоты». Запишите химические формулы известных вам кислот, в состав которых входит этот элемент. Назовите кислоты.
4. Какие аллотропные модификации кислорода и серы вы знаете? Чем они отличаются друг от друга?
5. Вдыхаемый человеком кислород соединяется с гемоглобином крови. Известно, что гемоглобин массой 1 г присоединяет кислород объёмом (н. у.) 1,35 см 3 . Содержание гемоглобина в крови здорового человека 140 г/дм3 . Общий объём крови - 6 дм3 . Рассчитайте химическое количество кислорода, которое может оказаться в крови человека.
6. Определите массовую долю сероводородной кислоты в растворе, полученном при растворении сероводорода объёмом (н. у.) 8,96 дм 3 в воде массой 500 г.
7. Расставьте коэффициенты в схемах следующих окислительно-восстановительных реакций:
а) H2 S + Cl2 + H2 O → H2 SO4 + HCl; б) H2 S + Br2 → S + HBr;
в) H2 S + O2 → S + H2 O.
В каждой реакции укажите окислитель и восстановитель.
§ 39. Кислородсодержащие соединения серы
В соединениях с кислородом сера проявляет степени окисления +4 и+6 .
Оксид серы(IV). Сернистая кислота
Оксид серы(IV) - SO2 (сернистый газ) - представляет собой бесцветный газ с резким характерным запахом, который получается при горении серы:
S + O2 =t SO2 .

Одно из самых древних применений серы связано с окуриванием горящей серой жилищ. Как писал древний историк Плиний-старший в I веке до н. э., «запахи горения серы могут предохранять от всяких чародейств и прогнать всякую нечистую силу». Дезинфицирующие и бактерицидные свойства оксида серы(IV) используются и в настоящее время. Сернистый газ применяют при обработке овощехранилищ, плодов и фруктов для того, чтобы предохранить их загнивание.
Раствор сернистого газа в воде (до 40 объёмов SO2 на 1 объём воды) - неустойчивая, двухосновнаясернистая кислота , которая существует только в растворе:
SO2 + H2 O H2 SO3 .
Сернистая кислота является слабой кислотой, в водных растворах она диссоциирует ступенчато с образованием гидросульфит- и сульфит-ионов:
H+ + HSO – , | – H+ + SO 2– . |
||||
Сернистая кислота проявляет химические свойства, общие для кислот: взаимодействует с основными оксидами, основаниями, вступает в реакции обмена с солями других кислот, в частности, вытесняет из солей более слабую угольную кислоту:
Na2 CO3 + H2 SO3 = Na2 SO3 + H2 O + CO2 .
Оксид серы(VI)
Оксид серы(VI) получают, окисляя оксид серы(IV) в присутствии катализатора при температуре около 500 С:
t, кат.
2SO + O −−−−−← 2SO .
2 2 ←−−−−−3
При обычных условиях оксид серы(VI) SO3 - бесцветная едкая жидкость, которая при температуре ниже 17 С превращается в белое кристаллическое вещество. Это типичный кислотный оксид, который взаимодействует с водой, образуя сильнуюсерную кислоту :
SO3 + H2 O = H2 SO4 .
Серная кислота
Графическая формула и модель молекулы серной кислоты приведены на рисунке 62.
Рис. 62. Графическая формула и модель молекулы серной кислоты
В разбавленных растворах серная кислота является сильным электролитом,
и её диссоциацию выражают следующим образом:
H2 SO4 → 2Н+ + SO4 2– .
Физические свойства серной кислоты
Серная кислота - тяжёлая (плотность 1,83 г/см3 ), бесцветная маслянистая жидкость без запаха. Она смешивается с водой в любых отношениях.
Процесс растворения H2 SO4 химическим количеством 1 моль сопровождается выделением 92 кДж теплоты, что сравнимо с величинами тепловых эффектов химических реакций. Выделение большого количества теплоты при взаимодействии серной кислоты с водой свидетельствует об образовании прочных соединений между этими двумя веществами -гидратов типа H2 SO4 ·n H2 O.
Например, H2 SO4 ·H2 O; H2 SO4 ·2H2 O; H2 SO4 ·3H2 O и т. д. Способность сер-
ной кислоты образовывать гидраты позволяет использовать её как сильный водоотнимающий агент, например для осушения газов.
Разогревание смеси при растворении серной кислоты в воде может сопровождаться её разбрызгиванием. Помните, что нельзя приливать воду к кис-
лоте, следует при непрерывном перемешивании раствора вливать кислоту в воду.
Химические свойства серной кислоты. Сульфаты
Сульфаты. Разбавленная серная кислота проявляет все характерные для кислот свойства: взаимодействует с металлами, стоящими в ряду активности до водорода; с основными и амфотерными оксидами, с основаниями и солями. При этом образуются соли: средние - сульфаты , например K 2 SO 4 , и кислые -
гидросульфаты , например KНSO4 .
Большинство сульфатов и гидросульфатов хорошо растворимы в воде, многие из них образуют кристаллогидраты . Некоторые кристаллогидраты солей серной кислоты называютсякупоросами : медный купорос CuSO4 ∙5H2 O, железный купорос FeSO4 ∙7H2 O и др.
Для качественного обнаружения серной кислоты и её солей в водных растворах используются растворимые соли бария:
Ba(NO3 )2 + Na2 SO4 = BaSO4 ↓ + 2NaNO3 ;
Ba2+ + SO4 2– = BaSO4 ↓.
В результате реакции образуется белый осадок сульфата бария.
Лабораторный опыт 6
Исследование химических свойств разбавленного раствора серной кислоты
В выданные вам пять пробирок поместите: металл (цинк или другой металл по выбору учителя), основный оксид, раствор гидроксида натрия, раствор карбоната натрия, раствор хлорида бария. В раствор гидроксида натрия добавьте несколько капель фенолфталеина и отметьте изменение его окраски. В каждую из пробирок прилейте по 1–2 см3 разбавленной серной кислоты. (Внимание! Если реакция с основным оксидом протекает медленно, ускорьте её протекание нагреванием на пламени спиртовки.)
Что вы наблюдаете? Какие признаки свидетельствуют о протекании химических реакций? Составьте уравнения химических реакций в молекулярном и ионном виде. Какая из проведённых вами реакций является окислительновосстановительной? Сделайте вывод о химических свойствах разбавленной серной кислоты.
Концентрированная серная кислота является более сильным окислителем, чем разбавленная. При взаимодействии концентрированной серной кислоты
с металлами водород не выделяется.
С металлами, стоящими в ряду активности после водорода (кроме золота и платины), реакция протекает с образованием оксида серы(IV) SO 2 :
Cu + 2H2 SO4(конц) =t CuSO4 + SO2 + 2H2 O.
В реакции с металлами, находящимися в ряду активности до водорода, концентрированная серная кислота может восстанавливаться до оксида серы(IV) SO2 , серы S или сероводорода H2 S в зависимости от активности металла и условий протекания реакции. Например:
4Zn + 5H2 SO4(конц) =t 4ZnSO4 + H2 S+ 4H2 O.
Напомним, что железо, алюминий и некоторые другие металлы при обычных условиях пассивируются концентрированной серной кислотой.
Концентрированная серная кислота способна взаимодействовать с простыми веществами неметаллами , например с серой:
S + 2H2 SO4 =t 3SO2 + 2H2 O.
Окисляя многие сложные органические соединения, серная кислота обугливает бумагу, ткань, древесину, одежду и кожу. Поэтому обращаться с концентрированной серной кислотой надо осторожно.
Концентрированная серная кислота способна вытеснять другие, более летучие кислоты из их солей. Например:
NaCl(тв) + H2 SO4(конц) =t NaНSO4 + HCl.
В Республике Беларусь серная кислота производится на ОАО «Гомельский химический завод», ОАО «Гродно Азот».
Области применения серной кислоты
Они представлены на рисунке 63.
Рис. 63. Применение серной кислоты
Серная кислота H2 SO4 - тяжёлая, бесцветная маслянистая жидкость без запаха.
Разбавленная серная кислота взаимодействует с металлами, стоящими в ряду активности до водорода; с оксидами металлов; с основаниями; с солями.
При взаимодействии концентрированной серной кислоты с металлами водород не выделяется.
Для качественного обнаружения серной кислоты и её солей в водных растворах используют растворимые соли бария.
Вопросы и задания
1. Запишите формулы известных вам оксидов и кислородсодержащих кислот серы. Укажите в них степени окисления атомов серы.
2. Определите массу серы, сгоревшей в кислороде, если при горении выделилось 29,69 кДж теплоты. Какое химическое количество оксида серы(VI) при этом образовалось? Тепловой эффект реакции горения серы составляет 296,9 кДж/моль.
3. Пользуясь таблицей растворимости солей, кислот и оснований в воде, составьте 2 уравнения реакций разбавленной серной кислоты с солями. Запишите уравнения
в молекулярном и ионном виде.
4. Рассчитайте массу и химическое количество сульфата бария, который образуется при действии разбавленной серной кислотой на раствор нитрата бария массой 200 г, массовая доля Ba(NO 3 )2 в котором равна 10 %.
5. Выпишите из текста параграфа уравнения реакций, характеризующих химические свойства концентрированной серной кислоты. Определите степени окисления атомов серы в её соединениях. В каждой реакции укажите окислитель и восстановитель.
6. Какой объём концентрированного раствора серной кислоты (= 1,83 г/см 3 ) с массовой долей H2 SO4 98 % необходим для растворения меди массой 6,4 г?
7. Расставьте коэффициенты в схемах уравнений следующих окислительновосстановительных реакций:
а) HBr + H2 SO4 → Br2 + SO2 + H2 O; б) CaSO4 → CaO + SO2 + O2 ;
в) K2 S + HClO → K2 SO4 + HCl.
В каждой реакции укажите окислитель и восстановитель.
§ 40. Понятие о выходе продукта химической реакции
Химические уравнения, составленные на основе закона сохранения массы веществ, позволяют проводить расчёты, в том числе вычислять массу, объём или химическое количество продукта реакции. На практике многие реакции протекают обратимо, часть вещества теряется в результате испарения, растворения или образования побочных продуктов. Поэтому продукта реакции всегда образуется меньше, чем должно было бы получиться в соответствии с расчётом по уравнению реакции. Таким образом, если принять теоретически рассчитанные по уравнению реакции массу, объём или химическое количество продукта за 100 %, то в реальном процессе выход продукта всегда будет меньше 100 %.
Обозначается выход продукта реакции буквой греческого алфавита (эта ) и выражается в долях единицы или процентах.
Выход продукта химической реакции - это величина, равная отношению массы (объёма, химического количества) фактически полученного продукта к массе (объёму, химическому количеству) продукта, вычисленной по уравнению реакции:
Во всех этих случаях будет найдено одно и то же значение выхода продукта химической реакции. Например, если известно, что для реакции окисления оксида серы(IV) до оксида серы(VI)
2SO2 + O2 2SO3
выход составляет 80 % (или 0,8), то это означает, что из оксида серы(IV) массой 64 г (объёмом 22,4 дм3 , химическим количеством 1 моль) мы получим оксид серы(VI) массой не 80 г (объёмом 22,4 дм3 , химическим количеством 1 моль), а массой 80 г∙0,8 = 64 г (объёмом 17,9 дм3 , химическим количеством
На основании величины выхода продукта в реальном производственном процессе делается вывод о полноте превращения сырья, затратах энергии, о необходимости введения дополнительных операций и пр.
Рассмотрим несколько примеров расчётов с использованием понятия «выход продукта реакции».
Пример 1 . В результате сжигания серы массой 48 г получен оксид серы(IV) объёмом (н. у.) 28,6 дм3 . Определите выход продукта реакции.
m (S) = 48 г | 1. Определим химическое количество серы, |
||||
V практ (SO2 ) = 28,6 дм3 | вступившей в реакцию: | ||||
m (S) | |||||
(SO2 ) = ? | n (S) | ||||
M (S) | 32 г / моль |
||||
2. Составим уравнение реакции получения оксида серы(IV): S + O2 = SO2 .
3. Найдём теоретическое количество оксида серы (IV):
1 моль S - 1 моль SO2 ;
1,5 моль S - 1,5 моль SO2 .
Понятие о выходе продукта химической реакции |
4. Найдём теоретический объём оксида серы(IV):
V теор (SO2 ) =n теор (SO2 )·V m = 1,5 моль·22,4 моль/дм3 = 33,6 дм3 .
5. Рассчитаем выход продукта реакции:
Ответ: выход продукта реакции равен 85 %.
Пример 2. Определите массу пирита FeS2 , который требуется подвергнуть обжигу для того, чтобы получить оксид серы(IV) объёмом (н. у.) 8,96 дм3 , если выход продукта реакции составляет 90 %.
V(SO2 ) = 8,96 дм3 | 1. Определим теоретический объём оксида серы(IV): |
|||||||||||
(SO2 ) = 90 % | V практ | V практ | ||||||||||
m (FeS2 ) = ? | Откуда V теор = | |||||||||||
V теор | ||||||||||||
Vтеор (SO2 ) = | V практ(SO 2) | 8,96 дм 3 | 9,56 дм3 . |
||||||||||
2. Найдём теоретическое химическое количество оксида серы(IV): |
||||||||||||
n теор(SO 2) | V теор(SO 2) | 9,56 дм3 | ||||||||||
22,4 дм3 /моль |
||||||||||||
3. Составим уравнение реакции получения оксида серы(IV) и рассчитаем химическое количество пирита, который необходимо подвергнуть обжигу:
x моль 0,4 моль
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3 , 4 моль 8 моль
х = 0,2 моль.
3. Определим массу пирита, который необходимо подвергнуть обжигу:m (FeS2 ) = 0,2 моль·120 г/моль = 24 г.
Ответ: для получения оксида серы(IV) потребуется пирит массой 24 г.

Выход продукта химической реакции - это величина, равная отношению массы (объёма, химического количества) фактически полученного продукта к массе (объёму, химическому количеству) продукта, вычисленной по уравнению реакции. Выражается в долях единицы или процентах.
Вопросы и задания
1. Почему практический выход продукта реакции обычно меньше, чем рассчитанный теоретически по уравнению реакции?
2. При реакции серы с водородом химическим количеством 1 моль образовался сероводород химическим количеством 0,85 моль. Определите выход продукта реакции.
3. В результате взаимодействия хлорида бария массой 200 г с серной кислотой выпал осадок сульфата бария массой 100 г. Рассчитайте выход продукта реакции.
4. Определите объём (н. у.) и химическое количество оксида серы(IV), образовавшегося при сгорании серы массой 64 г, если выход продукта реакции равен 75 %.
5. Вычислите массу сожжённой серы, если в результате получен оксид серы(IV) объёмом (н. у.) 89,6 дм 3 , что составляет 80 % от теоретически возможного.
6. Известно, что выход оксида серы(VI), полученного при окислении оксида серы(IV),
равен 85 %. Определите массу, объём (н. у.) и химическое количество оксида серы(IV), вступившего в реакцию, если получен оксид серы(VI) объёмом (н. у.) 2,24 дм3 .
7. Определите массовую долю соли в растворе, полученном при растворении меди массой 3,2 г в серной кислоте массой 192 г, если выход продукта реакции составляет 85 %.
§ 41. Азот и фосфор
Азот N ифосфор P расположены в группе VA периодической системы. К этой же группе периодической системы относятсямышьяк As,сурьма Sb ивисмут Bi. Азот и фосфор являются неметаллами, мышьяк и сурьму относят к полуметаллам, а висмут принадлежит к металлам.
Строение атомов и степени окисления
У атомов элементов группы VA на внешнем энергетическом уровне находится по 5 электронов, электронная конфигурация их внешнего энергетического уровня ns 2 np 3 , например: азота - 2s 2 2p 3 , фосфора - 3s 2 3p 3 .
7 N↓ | 15P ↓ |
Оборудование. На каждом столе перед учащимися план урока, схема взаимодействия азотной кислоты с металлами, набор реактивов, тесты для закрепления изученного материала.
Оксиды азота
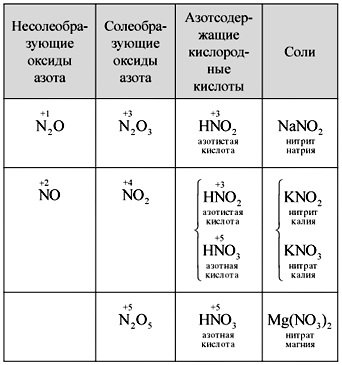
Учитель. Вспомните и напишите формулы оксидов азота. Какие оксиды называются солеобразующими, какие – несолеобразующими? Почему?
Ученики самостоятельно записывают формулы пяти оксидов азота, называют их, вспоминают азотсодержащие кислородные кислоты и устанавливают соответствие между оксидами и кислотами. Один из учеников записывает на доске (таблица).
Таблица
Сопоставление оксидов азота, кислот и солей
Демонстрационный опыт:
взаимодействие оксида азота(IV) с водой
Учитель. В сосуд с NO 2 приливаем немного воды и взбалтываем содержимое, затем испытываем полученный раствор лакмусом.
Что наблюдаем? Раствор краснеет из-за образовавшихся двух кислот.
2NO 2 + H 2 O = HNO 2 + HNO 3 .
Степень окисления азота в NO 2 равна +4, т.е. она является промежуточной между +3 и +5, которые в растворе более устойчивы, поэтому оксиду азота(IV) соответствуют сразу две кислоты – азотистая и азотная.
Состав и строение молекулы
Учитель. На доске запишите молекулярную формулу азотной кислоты, вычислите ее молекулярную массу и отметьте степени окисления элементов. Составьте структурную и электронную формулы.
Ученики составляют следующие формулы (рис. 1).

Учитель. Согласно этим формулам вокруг азота вращается десять электронов, но этого не может быть, т.к. азот находится во втором периоде и максимально на внешнем слое у него может быть только восемь электронов. Это противоречие устраняется, если предположить, что между атомом азота и одним из атомов кислорода образуется ковалентная связь по донорно-акцепторному механизму (рис. 2).
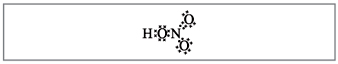
Рис. 2. Электронная формула азотной кислоты.
Электроны атома азота обозначены черными точками
Тогда структурную формулу азотной кислоты можно было бы изобразить так (рис. 3):
Рис. 3. Структурная формула азотной кислоты
(донорно-акцепторная связь показана стрелкой)
Однако опытным путем доказано, что двойная связь равномерно распределена между двумя атомами кислорода. Степень окисления азота в азотной кислоте равна +5, а валентность (обратите внимание) равна четырем, ибо имеются только четыре общие электронные пары.
Физические свойства азотной кислоты
Учитель. Перед вами флаконы с разбавленной и концентрированной азотной кислотой. Опишите физические свойства, которые вы наблюдаете .
Ученики описывают азотную кислоту как жидкость тяжелее воды, желтоватого цвета, с резким запахом. Раствор азотной кислоты без цвета и без запаха.
Учитель. Я добавлю, что температура кипения азотной кислоты +83 °С, температура замерзания –41 °С, т.е. при обычных условиях это жидкость. Резкий запах и то, что при хранении она желтеет, объясняется тем, что концентрированная кислота малоустойчива и под действием света или при нагревании частично разлагается.
Химические свойства кислоты
Учитель. Вспомните, с какими веществами взаимодействуют кислоты? (Учащиеся называют.)
Перед вами реактивы, проделайте перечисленные реакции и запишите свои наблюдения (реакции записывать надо в свете ТЭД).
А теперь обратимся к специфическим свойствам азотной кислоты.
Мы отметили, что кислота при хранении желтеет, теперь докажем это химической реакцией:
4HNO 3 = 2H 2 O + 4NO 2 + O 2 .
(Учащиеся самостоятельно записывают электронный баланс реакции.)
Выделяющийся «бурый газ» (NO 2) окрашивает кислоту.
Особо ведет себя эта кислота по отношению к металлам. Вы знаете, что металлы вытесняют водород из растворов кислот, но при взаимодействии с азотной кислотой этого не происходит.
Посмотрите на схему у вас на парте (рис. 4), где показано, какие газы выделяются при реакции кислоты различной концентрации с металлами. (Работа со схемой.)

Демонстрационный опыт:
взаимодействие концентрированной азотной кислоты с медью
Очень эффективна демонстрация реакции азотной кислоты (конц.) с порошком меди или мелко нарезанными кусочками медной проволоки:
Учащиеся самостоятельно записывают электронный баланс реакции:

Получение кислоты
Учитель. Урок будет неполным, если мы не рассмотрим вопрос получения азотной кислоты.
Лабораторный способ: действие концентрированной серной кислоты на нитраты (рис. 5).
NaNO 3 + H 2 SO 4 = NaHSO 4 + HNO 3 .
В промышленности кислоту в основном получают аммиачным способом.
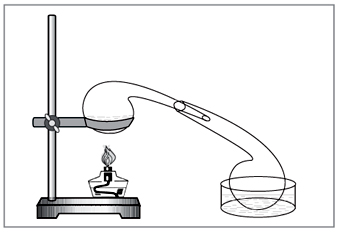
Рис. 5. Для получения азотной кислоты в лаборатории до сих пор
удобно использовать старинную химическую посуду – реторту
Способ получения кислоты из азота и кислорода при температуре свыше 2000 °С (электродуговой) особого распространения не получил.
В России история получения азотной кислоты связана с именем химика-технолога Ивана Ивановича Андреева (1880–1919).
Он в 1915 г. создал первую установку по производству кислоты из аммиака и реализовал разработанный способ в заводском масштабе в 1917 г. Первый завод был построен в Донецке.
Этот метод включает несколько этапов.
1) Подготовка аммиачно-воздушной смеси.
2) Окисление аммиака кислородом воздуха на платиновой сетке:
4NH 3 + 5O 2 = 4NO + 6H 2 O.
3) Дальнейшее окисление оксида азота(II) до оксида азота(IV):
2NO + O 2 = 2NO 2 .
4) Растворение оксида азота(IV) в воде и получение кислоты:
3NO 2 + H 2 O = 2HNO 3 + NO.
Если растворение проводить в присутствии кислорода, то весь оксид азота(IV) переходит в азотную кислоту.
5) Заключительный этап получения азотной кислоты – очистка газов, выходящих в атмосферу, от оксидов азота. Состав этих газов: до 98% азота, 2–5% кислорода и 0,02–0,15% оксидов азота. (Азот изначально был в воздухе, взятом для окисления аммиака.) Если оксидов азота в этих отходящих газах больше 0,02%, то специально проводят каталитическое восстановление их до азота, потому что даже такие малые количества этих оксидов приводят к большим экологическим проблемам.
После всего сказанного возникает вопрос: а зачем нам нужна кислота?
Применение кислоты
Учитель. Азотную кислоту используют для производства: азотных удобрений, и в первую очередь аммиачной селитры (как ее получают?); взрывчатых веществ (почему?); красителей; нитратов, о которых речь пойдет на следующем уроке.
Закрепление материала
Фронтальный опрос класса
– Почему степень окисления азота в азотной кислоте +5, а валентность четыре?
– С какими металлами азотная кислота не вступает в реакцию?
– Вам нужно распознать соляную и азотную кислоты, на столе три металла – медь, алюминий и железо. Как вы поступите и почему?
Тест
В а р и а н т 1
1. Какой ряд чисел соответствует распределению электронов по энергетическим уровням в атоме азота?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Закончите уравнения практически осуществимых реакций:
1) HNO 3 (разб.) + Cu … ;
2) Zn + HNO 3 (конц.) … ;
3) HNO 3 + MgCO 3 … ;
4) CuO + KNO 3 … .
3. Укажите, какое уравнение иллюстрирует одну из стадий процесса промышленного производства азотной кислоты.
1) 4NH 3 + 5O 2 = 4NO + 6H 2 O;
2) 5HNO 3 + 3P + 2H 2 O = 3H 3 PO 4 + 5NO;
3) N 2 + O 2 = 2NO.
4. Отрицательная степень окисления проявляется азотом в соединении:
1) N 2 O; 2) NO; 3) NO 2 ; 4) Na 3 N.
5. Взаимодействие медной стружки с концентрированной азотной кислотой приводит к образованию:
1) NO 2 ; 2) NO; 3) N 2 ; 4) NH 3 .
В а р и а н т 2
1. Значение высшей валентности азота равно:
1) 1; 2) 2; 3) 5; 4) 4.
2. Запишите возможное взаимодействие концентрированной азотной кислоты со следующими металлами: натрий, алюминий, цинк, железо, хром.
3. Выберите вещества, являющиеся сырьем для производства азотной кислоты:
1) азот и водород;
2) аммиак, воздух и вода;
3) нитраты.
4. Концентрированная азотная кислота не реагирует с:
1) углекислым газом;
2) соляной кислотой;
3) углеродом;
4) гидроксидом бария.
5. При взаимодействии очень разбавленной кислоты с магнием образуется:
1) NO 2 ; 2) NO; 3) N 2 O; 4) NH 4 NO 3 .
Ответы на тесты В а р и а н т 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. В а р и а н т 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Возможно, будет полезно почитать:
- Патриарх кирилл запретил актеру и священнику ивану охлобыстину служить в церкви Охлобыстин церковный сан ;
- Иван охлобыстин - биография, информация, личная жизнь Почему охлобыстин ушел из священников ;
- Ужин для ребенка 4 лет рецепты меню ;
- Принципы функционирования бюджетной системы РФ ;
- Особенности размещения населения на территории земли Население земли размещается равномерно средняя плотность населения ;
- Тонька-пулеметчица — cтрашная судьба страшного человека Фильм палач тонька пулеметчица реальная история ;
- Как поздравить начальницу с юбилеем? ;
- Российские студенты выиграли чемпионат мира по программированию Вот они, герои ;