Растворить железо в обычных условиях без нагревания. Соединения железа. Железо: физические и химические свойства
Железо проявляет умеренную химическую активность. Оно горит в атмосфере кислорода, образуя оксид Fe 2 O 3 . В мелкораздробленном состоянии металл пирофорен, т.е. способен самовозгораться на воздухе. Тонкий порошок железа можно получить при термическом разложении оксалата железа в атмосфере водорода.
При хранении на воздухе при температуре до 200°C железо постепенно покрывается плотной пленкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближенно ее химическую формулу можно записать как Fe 2 O 3 .
Железо реагирует с расплавленной серой, образуя сульфид, активно взаимодействует с хлором, бромом и иодом с образованием трихлорида, трибромида и дииодида. С фтором железо реагирует слабо из-за образования на поверхности плотной мало летучей пленки трифторида. При температурах более 500° С металл обратимо взаимодействует с углеродом:
Карбид железа такого состава называют цементитом. Он содержится в чугунах и сталях.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe 2 О 3 , при сгорании в чистом кислороде - оксид Fe 3 О 4 . Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeО.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe 2 P и Fe 3 P, с углеродом, образуя карбид Fe 3 C, с кремнием, образуя несколько силицидов, например, FeSi. При повышенном давлении металлическое железо реагирует с монооксидом углерода СО, причем образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO) 5 . Известны также карбонилы железа составов Fe 2 (CO) 9 и Fe 3 (CO) 12 . Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава .
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная пленка пассивирует его поверхность. С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
Fe + 2HCl = FeCl 2 + H 2
Fe + H 2 SO 4 = FeSO 4 + H 2
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа (III):
2Fe + 4H 2 SO 4 = Fe 2 (SO 4) 3 + SO 2 + 4H 2 O
Под действием атмосферной влаги и воздуха железо коррозирует (ржавеет):
4Fe + 2H 2 O + 3O 2 = 4FeO(OH)
За счет коррозии ежегодно теряется до 10% всего производимого железа.
Очень чистое железо, содержащее менее 0,01% примесей серы, углерода и фосфора, устойчиво к коррозии. Близ г. Дели в Индии стоит железная колонна, поставленная еще в 9 в. до н.э., на которой нет никаких признаков ржавчины. Она сделана из очень чистого металла с содержанием железа 99,72%. Не последнюю роль в коррозионной устойчивости материала знаменитой колонны могут играть климатические особенности этой местности.
Металлическое железо взаимодействует при нагревании с концентрированными (более 30%) растворами щелочей, образуя гидроксокомплексы. Под действием сильных окислителей при нагревании железо может образовывать соединения в степени окисления (+VI) – ферраты:
Fe + 2KNO 3 = K 2 FeO 4 + 2NO
Для железа известны оксиды и гидроксиды в степенях окисления (II) и (III).
Железо образует простые соли почти со всеми анионами. Растворимы в воде нитраты, сульфаты, галогениды (кроме фторидов), ацетаты и др. Катион железа(II) может быть окислен многими окислителями до катиона железа(III). Растворы солей железа(II) и его твердые соли постепенно окисляются даже просто при хранении на воздухе:
4FeCO 3 + 2H 2 O + O2 = 4FeO(OH) + 2CO 2
4FeS + 6H 2 O + O 2 = 4FeO(OH) + 4H 2 S
Наиболее устойчивой твердой солью железа(II) является гексагидрат сульфата железа(II)-аммония (NH4)2Fe(SO 4)2.6H 2 O (соль Мора).
При нагревании сульфаты, нитраты, карбонаты и оксалаты железа разлагаются. При этом железо(II) обычно окисляется до железа(III), например:
2FeSO 4 = Fe 2 O 3 + SO 3 + SO 2
Соли железа(III) подвергаются сильному гидролизу.
Общие сведения
Железо (лат. Ferrum), химический элемент VIII группы периодической системы Менделеева. Порядковый номер 26, атомная масса 55,847. Блестящий серебристо-белый металл. Элемент в природе состоит из четырех стабильных изотопов: (5,84%), (91,68%), (2,17%) и (0,31%).
Историческая справка. Железо было известно еще в доисторические времена, однако широкое применение нашло значительно позже, так как в свободном состоянии встречается в природе крайне редко, а получение его из руд стало возможным лишь на определенном уровне развития техники. Вероятно, впервые человек познакомился с метеоритным Железом, о чем свидетельствуют его названия на языках древних народов: древнеегипетское "бени-пет" означает "небесное железо"; древнегреческое sideros связывают с латинским sidus (род. падеж sideris) – звезда, небесное тело. В хеттских текстах 14 века до н. э. упоминается о Железе как о металле, упавшем с неба. В романских языках сохранился корень названия, данного римлянами (например, франц. fer, итал. ferro).
Химические свойства железа и его соединений
Железо – это химический элемент №26, который находится в побочной подгруппе VIII группы, в четвертом периоде. Электронная конфигурация атома железа .
Степени окисления железа: 0,+2,+3.
Соединения железа (III) проявляют слабые окислительные свойства, образуемые оксиды и гидроксиды и проявляют амфотерные свойства, хотя основные свойства у этих соединений значительно преобладают.
1. Взаимодействие с неметаллами.
При нагревании железо особенно порошкообразное способно взаимодействовать практически со всеми неметаллами. Хлор и фтор окисляют железо до , бром может окислить и до и до в зависимости от количества, а йод окисляет только до степени окисления +2 . При реакции с серой сначала образуется сульфид железа, а затем дисульфид железа.
→
→
природный минерал такого состава называется пирит.
Он используется для получения серной кислоты, а также железа и соединений железа.
2. Взаимодействие железа с кислородом.
При взаимодействии железа с кислородом в зависимости от его количества, могут образовываться разные оксиды. В том числе и смешанный оксид .
→
→
→
3. Взаимодействие железа с водой.
При сильном нагревании металлическое железо взаимодействует с водой.![]() →
→![]()
Во влажном воздухе при обычных условиях железо реагирует с парами воды и кислородом, с образованием ржавчины. Она состоит из смешенных оксидов, гидроксидов и соединений кислорода. Это не индивидуальное вещество.
Примерная схема ржавления железа:![]() →
→
4. Взаимодействие железа с кислотами.
Как и другие типичные металлы, железо взаимодействует с кислотами не окислителями с выделением водорода.
→
С кислотами окислителями железо не реагирует из-за пассивации. Но с разбавленными кислотами реакция происходит.![]() →
→ 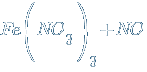
5. С растворами солей.
Металлическое железо вытесняет менее активные металлы из растворов их солей.![]() →
→ ![]()
Амфотерные свойства железа.
Железо и некоторые его соединения способны проявлять амфотерные свойства.
→ ![]()
В горячем концентрированном растворе щелочи образуется комплексное соединение и выделяется водород.
Соединения железа(II)
Соли железа (II) можно получить при взаимодействии металлического железа с кислотами не окислителями или восстановлением железа(III).
![]() →
→
Соединения железа(II) обладают восстановительными свойствами.![]() → ↓.
→ ↓.
На воздухе ↓окисляется кислородом.
↓![]() → ↓
→ ↓
Соединения железа(III)
Соли железа(III) получают либо окислением железа галогенами, либо при его взаимодействии с разбавленными кислотами окислителями. Соли железа(III) могут проявлять слабые окислительные свойства.
![]() →
→ ![]() ↓ .
↓ .
На этой реакции основан йодометрический способ определения солей железа.
Качественная реакция на соли железа(III)
![]() →
→![]() .
.
При взаимодействии с роданидами образуются ярко-красные похожие на кровь комплексы различного состава.
Взаимодействие со щелочью.![]() → ↓
→ ↓
↓как и ↓ амфотерен, с преобладание основных свойств.
↓ → ![]()
→ ![]()
Железная кислота и её соли.
При окислении ↓ или при электролизе раствора щелочи на железном аноде образуются соли, содержащие железо в составе аниона:![]() →
→![]() →
→ ![]()
Железо имеет степень окисления +6 .Такие соли называются ферраты: ![]() . Это соли несуществующей в свободном виде железной кислоты . Они относятся к наиболее сильным органическим окислителям и способны медленно окислять даже воду.
. Это соли несуществующей в свободном виде железной кислоты . Они относятся к наиболее сильным органическим окислителям и способны медленно окислять даже воду.
Значение переходных металлов для организма и жизнедеятельности
Без переходных металлов наш организм существовать не может. Железо – это действующее начало гемоглобина. Цинк участвует в выработке инсулина. Кобальт – центр витамина В-12. Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов.
Многие переходные металлы и их соединения используются в качестве катализаторов. Например, реакция гидрирования алкенов на платиновом или палладиевом катализаторе. Полимеризация этилена проводится с помощью титансодержащих катализаторов.
Большое использование сплавов переходных металлов: сталь, чугун, бронза, латунь, победит. 
При исследовании сплавов прослеживается уникальное значение железа для человека. Сплавы даже разделяют на черные и цветные по содержанию в них железа.
Цель: на основании положения в периодической системе химических элементов, строения атома железа учащиеся должны составить представление о физических и химических свойствах железа.
Реактивы. На демонстрационном столе опилки железа, серная кислота (разбавленная), раствор сульфата меди (2), речной песок, вода дистиллированная. Штатив с пробирками, пипетки, пробка с газоотводной трубкой, стакан, лабораторный штатив, спиртовка.
На ученических столах - серная кислота (разбавленная), сульфат меди (2), опилки железные, штатив с пробирками, пипетки.
Оборудование: карта «Минеральные ресурсы» и таблица «План урока». Коллекция «Полезные ископаемые»; 3 конверта с заданиями.
Ход урока
1. Изучение нового материала.
УЧИТЕЛЬ. Ребята! Послушайте отрывок из «Поэмы о периодическом законе», В. Половняк.
Громоподобные раскаты
И в небе раскаленный след:
На землю новый камень падал
И ужасался человек
Но редким был подарок неба
Им лишь счастливец обладал:
Топор был выкован железный,
Сверкает лезвием кинжал.
Вот длинный ряд тысячелетний
Приходит в поисках, в борьбе,
И наступает век железный
Кровавый беспокойный век.
Проблемный вопрос: на каком древнем языке железо именуют «небесным камнем»?
(ученики выдвигают версии на поставленный вопрос).
Сообщение ученика. 30 июня 1908 году эвенка Чучанги рассказывал: тут я увидел страшное диво - лесины падают, хвоя горит. Жарко очень. Жарко сгореть можно. Вдруг над горой, где уже упал лес, стало сильно светло, будто второе солнце появилось. Эту местность эвенки стали называть «страной мертвого леса», площадь радиусом 25-30 км после падения метеорита.
При падении Тунгусского метеорита по всей Центральной Сибири был виден ослепительно-яркий свет. Установлено, что в земную атмосферу со скоростью 70 км/с влетело метеоритное тело массой 1000000 т. Удары огромной силы, подобные взрывам, были слышны, в тысяче километров от места падения! Куски «небесного тела», которые называют «метеоритами», бывают похожи на камни черно-бурого цвета. В свободном состоянии железо встречается только в метеоритах. Ежесуточно на Землю выпадают до 10 т метеоритного вещества.
УЧИТЕЛЬ. Итак, запишите в свои тетради тему урока: Железо. Строение атома, физические и химические свойства.
Цель урока: на основании положения в периодической системе химических элементов, строение атома железа составить представление о физических и химических свойствах железа.
1. Строение и свойства атомов.
Что можно дополнительно сказать о железе на основании положения его в периодической системе химических элементов? (Ученики сообщают - 8 группа, побочная подгруппа, 4 большой период, d-элемент. Химическое знак – Fe. Порядковый номер – 26. Относительная атомная масса (Ar) – 56).
УЧИТЕЛЬ. А теперь я прошу вас написать строение атома, электронную и графическую формулы железа? (к доске приглашаются ученики).
Ученики составляют следующую запись:
Схема строения атома:Fe +26) 2) 8) 14) 2 .
Электронная формула атома 1s 2 2s 2 p 6 3s 2 p 6 4s 2 3d 6 .
Графическая схема:
В соединениях железо проявляет степень окисления, в основном +2 и +3, реже +4 и +6. Как и всегда при изучении соединений, мы рассмотрим физические свойства железа:
2. Физические свойства железа.
Вашим помощником на этом уроке будет таблица «План урока», которая висит на доске (см. приложение). Прошу вас использовать ее в работе на сегодняшнем уроке. (Учитель демонстрирует опилки железа). Начнем с физических свойств железа. Блестящий серебристо-белый металлический. Один из наиболее распространенных элементов в природе, по содержанию в земной коре (4,65% по массе) уступает лишь кислороду, кремнию и алюминию. Оно входит в состав многих оксидных руд – гематита, или красного железняка Fe 2 O 3 , магнетита Fe 3 O 4 , пирита FeS 2 и др.
Комментируя руды, учитель демонстрирует коллекцию «Полезные ископаемые» и просит учеников на карте «Минеральные ресурсы», найти основные месторождения и назвать их?
УЧИТЕЛЬ. Сравним атомный радиус железа 0,126 нм с атомным радиусом натрия 0,186 нм, магния 0,16 нм, алюминии 0,14 нм. Какое влияние на свойства железа оказывает такие размеры атома и возможность отдавать электроны c внешнего и предпоследнего слоя?
Железо, имеющее атомы небольших размеров и большое число электронов, участвующих в металлической связи, должно обладать высокой температурой плавления и значительной твердостью, но вместе с тем сравнительно небольшой электропроводностью. Железо тугоплавкое – tпл = 1539°С, относительно мягкое (по школе твердость его равна 4), способен сильно притягиваться магнитами.
У железа есть две аллотропные модификации: альфа-железа устойчивое до 910°С, имеет кубическую объемно-центрированную решетку; гамма-железо t=910 – 1400°С – кубическую гранецентрированную.
Железо может отдавать электроны, находящиеся на двух (внешнем и предпоследнем) слоях. Проявляет восстановительные свойства. Степень железа зависит от окислительной способности реагирующих с ним веществ. Итак, химические свойства железа:
3. Химические свойства железа.
Познакомимся с химическими свойствами железа: искры, вырывающиеся при резке стального инструмента, представляет с собой раскаленные частички окалины. В кислороде железо сгорает, разбрасывая искры – частички железной окалины Fe3 O4.
Свойства №1 Взаимодействия железа с кислородом:
промежуточный оксид

Свойства №2 Взаимодействие железа с водой :
Учитель пишет на доске уравнение реакции и просит уравнять его с помощью электронного баланса. Это задание выполняет ученик у доски, а остальные – на своих рабочих местах:
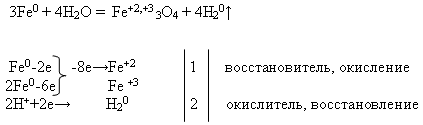
Затем учитель проводит демонстрацию опыта «Взаимодействия железа с водой» (см. приложение).
Свойство №3 Взаимодействие железа с разбавленными кислотами:
УЧИТЕЛЬ. Используя предложенные вам реактивы, проведите химическую реакцию, о которой идет речь. Напишите уравнение реакции в молекулярном и ионном виде. Докажите, что железо в данном процессе проявляет свойство восстановителя.
Учитель приглашает к доске ученика, который проводит эксперимент и записывает уравнение реакции, а остальные выполняют предложенное задание на своих рабочих местах:
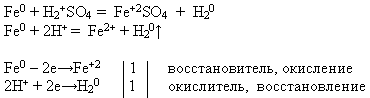
В электрохимическом ряду напряжений металлов железо расположено до водорода. Поэтому оно растворяется в разбавленных серной и соляной кислотах, вытесняя из них водород и образуя соответствующую соль, степень окисления +2.
Свойства №4 Взаимодействие с растворами солей:
УЧИТЕЛЬ. Используя предложенные вам реактивы, проведите химическую реакцию, о которой идет речь. Напишите уравнение реакции в молекулярном и ионном виде – это задание делают ученики первого варианта, а ученики второго варианта – докажите, что железо в данном процессе проявляет свойство восстановителя.
Учитель приглашает к доске ученика, который проводит эксперимент. А остальные выполняют предложенное задание на своих рабочих местах:
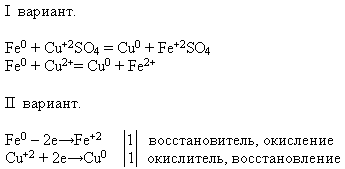
2. Подведем итоги урока по таблице «План урока»
3. Закрепление материала.
УЧИТЕЛЬ. Ребята! К нам на урок химии прислали три конверта, в них помещены задания для тех, кто хочет получить отметку «5» и «4». Приглашаю к доске желающих. Ученикам, работающим на своих местах, можно выполнить задание по своему усмотрению.
№1 конверт (за правильно выполненное задание – «5»).
№2 конверт (за правильное выполненное задания – «4»).
УЧИТЕЛЬ. Ребята! У нас еще остался конверт (учитель показывает конверт). Что же здесь находится? (Учитель вскрываетконверт и читает). Домашнее задание (записывает на доске домашнее задание).
Учить §14 до статьи «Соединение железа», по рабочей тетради тема «Железо» №3-4 письменно.
Завершая знакомство со свойствами железа, хочу напомнить, насколько химия многолика. Она дает ученику огромные возможности, но при этом требует ответственного отношения и понимания химических реакций. Надеюсь, что полученные сведения окажутся вам полезными.
Железо было известно еще в доисторические времена, однако широкое применение нашло значительно позже, так как в свободном состоянии встречается в природе крайне редко, а получение его из руд стало возможным лишь на определенном уровне развития техники. Вероятно, впервые человек познакомился с метеоритным Железом, о чем свидетельствуют его названия на языках древних народов: древнеегипетское "бени-пет" означает "небесное железо"; древнегреческое sideros связывают с латинским sidus (род. падеж sideris) - звезда, небесное тело. В хеттских текстах 14 века до н. э. упоминается о Железе как о металле, упавшем с неба. В романских языках сохранился корень названия, данного римлянами (например, франц. fer, итал. ferro).
Способ получения Железа из руд был изобретен в западной части Азии во 2-м тысячелетии до н. э.; вслед за тем применение Железа распространилось в Вавилоне, Египте, Греции; на смену бронзовому веку пришел железный век. Гомер (в 23-й песне "Илиады") рассказывает, что Ахилл наградил диском из железной крицы победителя в соревновании по метанию диска. В Европе и Древней Руси в течение многих веков Железо получали по сыродутному процессу. Железную руду восстанавливали древесным углем в горне, устроенном в яме; в горн мехами нагнетали воздух, продукт восстановления - крицу ударами молота отделяли от шлака и из нее выковывали различные изделия. По мере усовершенствования способов дутья и увеличения высоты горна температура процесса повышалась и часть Железа науглероживалась, то есть получался чугун; этот сравнительно хрупкий продукт считали отходом производства. Отсюда название чугуна "чушка", "свинское железо" - англ. pig iron. Позже было замечено, что при загрузке в горн не железной руды, а чугуна также получается низкоуглеродистая железная крица, причем такой двухстадийный процесс оказался более выгодным, чем сыродутный. В 12-13 веках кричный способ был уже широко распространен.
В 14 веке чугун начали выплавлять не только как полупродукт для дальнейшего передела, но и как материал для отливки различных изделий. К тому же времени относится и реконструкция горна в шахтную печь ("домницу"), а затем и в доменную печь. В середине 18 века в Европе начал применяться тигельный процесс получения стали, который был известен на территории Сирии еще в ранний период средневековья, но в дальнейшем оказался забытым. При этом способе сталь получали расплавлением металлической шихты в небольших сосудах (тиглях) из высокоогнеупорной массы. В последней четверти 18 века стал развиваться пудлинговый процесс передела чугуна в Железо на поду пламенной отражательной печи. Промышленный переворот 18 - начала 19 веков, изобретение паровой машины, строительство железных дорог, крупных мостов и парового флота вызвали громадную потребность в Железе и его сплавах. Однако все существовавшие способы производства Железа не могли удовлетворить потребности рынка. Массовое производство стали началось лишь в середине 19 века, когда были разработаны бессемеровский, томасовский и мартеновский процессы. В 20 веке возник и получил широкое распространение электросталеплавильный процесс, дающий сталь высокого качества.
Распространение Железа в природе. По содержанию в литосфере (4,65% по массе) Железо занимает второе место среди металлов (на первом алюминий). Оно энергично мигрирует в земной коре, образуя около 300 минералов (окислы, сульфиды, силикаты, карбонаты, титанаты, фосфаты и т. д.). Железо принимает активное участие в магматических, гидротермальных и гипергенных процессах, с которыми связано образование различных типов его месторождений. Железо - металл земных глубин, оно накапливается на ранних этапах кристаллизации магмы, в ультраосновных (9,85%) и основных (8,56%) породах (в гранитах его всего 2,7%). В биосфере Железо накапливается во многих морских и континентальных осадках, образуя осадочные руды.
Важную роль в геохимии Железа играют окислительно-восстановительные реакции - переход 2-валентного Железа в 3-валентное и обратно. В биосфере при наличии органических веществ Fe 3+ восстанавливается до Fe 2+ и легко мигрирует, а при встрече с кислородом воздуха Fe 2+ окисляется, образуя скопления гидрооксидов 3-валентного Железа. Широко распространенные соединения 3-валентного Железа имеют красный, желтый, бурый цвета. Этим определяется окраска многих осадочных горных пород и их наименование -"красноцветная формация" (красные и бурые суглинки и глины, желтые пески и т. д.).
Физические свойства Железа. Значение Железа в современное технике определяется не только его широким распространением в природе, но и сочетанием весьма ценных свойств. Оно пластично, легко куется как в холодном, так и нагретом состоянии, поддается прокатке, штамповке и волочению. Способность растворять углерод и других элементы служит основой для получения разнообразных железных сплавов.
Железо может существовать в виде двух кристаллических решеток: α- и γ-объемноцентрированной кубической (ОЦК) и гранецентрированной кубической (ГЦК). Ниже 910°С устойчиво α-Fe с ОЦК-решеткой (а = 2,86645Å при 20 °С). Между 910 °С и 1400°С устойчива γ-модификация с ГЦК-решеткой (а = 3,64Å). Выше 1400°С вновь образуется ОЦК-решетка δ-Fe (a = 2,94Å), устойчивая до температуры плавления (1539 °С). α-Fe ферромагнитно вплоть до 769 °С (точка Кюри). Модификации γ-Fe и δ-Fe парамагнитны.
Полиморфные превращения Железа и стали при нагревании и охлаждении открыл в 1868 году Д. К. Чернов. Углерод образует с Железом твердые растворы внедрения, в которых атомы С, имеющие небольшой атомный радиус (0,77Å), размещаются в междоузлиях кристаллической решетки металла, состоящей из более крупных атомов (атомный радиус Fe 1,26 Å). Твердый раствор углерода в γ-Fe называется аустенитом, а в α-Fe - ферритом. Насыщенный твердый раствор углерода в γ-Fe содержит 2,0% С по массе при 1130 °С; α-Fe растворяет всего 0,02- 0,04% С при 723 °С, и менее 0,01% при комнатной температуре. Поэтому при закалке аустенита образуется мартенсит - пересыщенный твердый раствор углерода в α-Fe, очень твердый и хрупкий. Сочетание закалки с отпуском (нагревом до относительно низких температур для уменьшения внутренних напряжений) позволяет придать стали требуемое сочетание твердости и пластичности.
Физические свойства Железа зависят от его чистоты. В промышленных железных материалах Железу, как правило, сопутствуют примеси углерода, азота, кислорода, водорода, серы, фосфора. Даже при очень малых концентрациях эти примеси сильно изменяют свойства металла. Так, сера вызывает так называемых красноломкость, фосфор (даже 10 -2 % Р) - хладноломкость; углерод и азот уменьшают пластичность, а водород увеличивает хрупкость Железа (т. н. водородная хрупкость). Снижение содержания примесей до 10 -7 - 10 -9 % приводит к существенным изменениям свойств металла, в частности к повышению пластичности.
Ниже приводятся физические свойства Железа, относящиеся в основном к металлу с общим содержанием примесей менее 0,01% по массе:
Атомный радиус 1,26Å
Ионные радиусы Fe 2+ 0,80Å, Fe 3+ 0.67Å
Плотность (20°C) 7 ,874 г/см 3
t кип около 3200°С
Температурный коэффициент линейного расширения (20°С) 11,7·10 -6
Теплопроводность (25°С) 74,04 вт/(м·K)
Теплоемкость Железа зависит от его структуры и сложным образом изменяется с температурой; средняя удельная теплоемкость (0-1000°С) 640,57 дж/(кг·К) .
Удельное электрическое сопротивление (20°С) 9,7·10 -8 ом·м
Температурный коэффициент электрического сопротивления (0-100°С) 6,51·10 -3
Модуль Юнга 190-210·10 3 Мн/м 2 (19-21·10 3 кгс/мм 2)
Температурный коэффициент модуля Юнга 4·10 -6
Модуль сдвига 84,0·10 3 Мн/м 2
Кратковременная прочность на разрыв 170-210 Мн/м 2
Относительное удлинение 45-55%
Твердость по Бринеллю 350-450 Мн/м 2
Предел текучести 100 Мн/м 2
Ударная вязкость 300 Мн/м 2
Химические свойства Железа. Конфигурация внешней электронной оболочки атома 3d 6 4s 2 . Железо проявляет переменную валентность (наиболее устойчивы соединения 2- и 3-валентного Железа). С кислородом Железо образует оксид (II) FeO, оксид (III) Fe 2 O 3 и оксид (II,III) Fe 3 O 4 (соединение FeO c Fe 2 O 3 , имеющее структуру шпинели). Во влажном воздухе при обычной температуре Железо покрывается рыхлой ржавчиной (Fe 2 O 3 ·nH 2 O). Вследствие своей пористости ржавчина не препятствует доступу кислорода и влаги к металлу и поэтому не предохраняет его от дальнейшего окисления. В результате различных видов коррозии ежегодно теряются миллионы тонн Железа. При нагревании Железа в сухом воздухе выше 200 °С оно покрывается тончайшей оксидной пленкой, которая защищает металл от коррозии при обычных температурах; это лежит в основе технического метода защиты Железа - воронения. При нагревании в водяном паре Железо окисляется с образованием Fe 3 O 4 (ниже 570 °С) или FeO (выше 570 °С) и выделением водорода.
Гидрооксид Fe(OH) 2 образуется в виде белого осадка при действии едких щелочей или аммиака на водные растворы солей Fe 2+ в атмосфере водорода или азота. При соприкосновении с воздухом Fe(OH) 2 сперва зеленеет, затем чернеет и наконец быстро переходит в красно-бурый гидрооксид Fe(OH) 3 . Оксид FeO проявляет основные свойства. Оксид Fe 2 O 3 амфотерен и обладает слабо выраженной кислотной функцией; реагируя с более основными оксидами (например, с MgO, она образует ферриты - соединения типа Fe 2 O 3 ·nMeO, имеющие ферромагнитные свойства и широко применяющиеся в радиоэлектронике. Кислотные свойства выражены и у 6-валентного Железа, существующего в виде ферратов, например K 2 FeO 4 , солей не выделенной в свободном состоянии железной кислоты.
Железо легко реагирует с галогенами и галогеноводородами, давая соли, например хлориды FeCl 2 и FeCl 3 . При нагревании Железа с серой образуются сульфиды FeS и FeS 2 . Карбиды Железа - Fe 3 C (цементит) и Fe 2 C (е-карбид) - выпадают из твердых растворов углерода в Железе при охлаждении. Fe 3 C выделяется также из растворов углерода в жидком Железе при высоких концентрациях С. Азот, подобно углероду, дает с Железом твердые растворы внедрения; из них выделяются нитриды Fe 4 N и Fe 2 N. С водородом Железо дает лишь малоустойчивые гидриды, состав которых точно не установлен. При нагревании Железо энергично реагирует с кремнием и фосфором, образуя силициды (например, Fe 3 Si и фосфиды (например, Fe 3 P).
Соединения Железа с многими элементами (О, S и другими), образующие кристаллическую структуру, имеют переменный состав (так, содержание серы в моносульфиде может колебаться от 50 до 53,3 ат.%). Это обусловлено дефектами кристаллической структуры. Например, в оксиде Железа (II) часть ионов Fe 2+ в узлах решетки замещена ионами Fe 3+ ; для сохранения электронейтральности некоторые узлы решетки, принадлежавшие ионам Fe 2+ , остаются пустыми.
Нормальный электродный потенциал Железа в водных растворах его солей для реакции Fe = Fe 2+ + 2e составляет -0,44 в, а для реакции Fe = Fe 3+ + 3e равен -0,036 в. Таким образом, в ряду активностей Железо стоит левее водорода. Оно легко растворяется в разбавленных кислотах с выделением Н 2 и образованием ионов Fe 2+ . Своеобразно взаимодействие Железа с азотной кислотой. Концентрированная HNO 3 (плотность 1,45 г/см 3) пассивирует Железо вследствие возникновения на его поверхности защитной оксидной пленки; более разбавленная HNO 3 растворяет Железо с образованием ионов Fe 2+ или Fe 3+ , восстанавливаясь до NH 3 или N 2 и N 2 O. Растворы солей 2-валентного Железа на воздухе неустойчивы - Fe 2+ постепенно окисляется до Fe 3+ . Водные растворы солей Железа вследствие гидролиза имеют кислую реакцию. Добавление к растворам солей Fe 3+ тиоцианат-ионов SCN- дает яркую кроваво-красную окраску вследствие возникновения Fe(SCN) 3 что позволяет открывать присутствие 1 части Fe 3+ примерно в 10 6 частях воды. Для Железа характерно образование комплексных соединений.
Получение Железа. Чистое Железо получают в относительно небольших количествах электролизом водных растворов его солей или восстановлением водородом его окислов. Постепенно увеличивается производство достаточно чистого Железо путем его прямого восстановления из рудных концентратов водородом, природным газом или углем при относительно низких температурах.
Применение Железа. Железо - важнейший металл современной техники. В чистом виде Железо из-за его низкой прочности практически не используется, хотя в быту "железными" часто называют стальные или чугунные изделия. Основная масса Железа применяется в виде весьма различных по составу и свойствам сплавов. На долю сплавов Железа приходится примерно 95% всей металлической продукции. Богатые углеродом сплавы (свыше 2% по массе) - чугуны, выплавляют в доменных печах из обогащенных железом руд. Сталь различных марок (содержание углерода менее 2% по массе) выплавляют из чугуна в мартеновских и электрических печах и конвертерах путем окисления (выжигания) излишнего углерода, удаления вредных примесей (главным образом S, P, О) и добавления легирующих элементов. Высоколегированные стали (с большим содержанием никеля, хрома, вольфрама и других элементов) выплавляют в электрических дуговых и индукционных печах. Для производства сталей и сплавов Железа особо ответственного назначения служат новые процессы - вакуумный, электрошлаковый переплав, плазменная и электронно-лучевая плавка и другие. Разрабатываются способы выплавки стали в непрерывно действующих агрегатах, обеспечивающих высокое качество металла и автоматизацию процесса.
На основе Железа создаются материалы, способные выдерживать воздействие высоких и низких температур, вакуума и высоких давлений, агрессивных сред, больших переменных напряжений, ядерных излучений и т. п. Производство Железа и его сплавов постоянно растет.
Железо как художественный материал использовалось с древности в Египте, Месопотамии, Индии. Со времен средневековья сохранились многочисленные высокохудожественные изделия из Железа в странах Европы (Англии, Франции, Италии, России и других) - кованые ограды, дверные петли, настенные кронштейны, флюгера, оковки сундуков, светцы. Кованые сквозные изделия из прутьев и изделия из просечного листового Железа (часто со слюдяной подкладкой) отличаются плоскостными формами, четким линейно-графическим силуэтом и эффектно просматриваются на световоздушном фоне. В 20 веке Железо используется для изготовления решеток, оград, ажурных интерьерных перегородок, подсвечников, монументов.
Железо в организме. Железо присутствует в организмах всех животных и в растениях (в среднем около 0,02%); оно необходимо главным образом для кислородного обмена и окислительных процессов. Существуют организмы (так называемые концентраторы), способные накапливать его в больших количествах (например, железобактерии - до 17-20% Железа). Почти все Железо в организмах животных и растений связано с белками. Недостаток Железа вызывает задержку роста и явления хлороза растений, связанные с пониженным образованием хлорофилла. Вредное влияние на развитие растений оказывает и избыток Железа, вызывая, например, стерильность цветков риса и хлороз. В щелочных почвах образуются недоступные для усвоения корнями растений соединения Железа, и растения не получают его в достаточном количестве; в кислых почвах Железо переходит в растворимые соединения в избыточном количестве. При недостатке или избытке в почвах усвояемых соединений Железа заболевания растений могут наблюдаться на значительных территориях.
В организм животных и человека Железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовые, хлеб, крупы, шпинат, свекла). В норме человек получает с рационом 60-110 мг Железа, что значительно превышает его суточную потребность. Всасывание поступившего с пищей Железа происходит в верхнем отделе тонких кишок, откуда оно в связанной с белками форме поступает в кровь и разносится с кровью к различным органам и тканям, где депонируется в виде Железо-белкового комплекса - ферритина. Основное депо Железа в организме - печень и селезенка. За счет ферритина происходит синтез всех железосодержащих соединений организма: в костном мозге синтезируется дыхательный пигмент гемоглобин, в мышцах - миоглобин, в различных тканях цитохромы и других железосодержащие ферменты. Выделяется Железо из организма главным образом через стенку толстых кишок (у человека около 6-10 мг в сутки) и в незначительной степени почками. Потребность организма в Железе меняется с возрастом и физическим состоянием. На 1 кг веса необходимо детям - 0,6, взрослым-0,1 и беременным - 0,3 мг Железа в сутки. У животных потребность в Железе ориентировочно составляет (на 1 кг сухого вещества рациона): для дойных коров - не менее 50 мг, для молодняка - 30-50 мг; для поросят - до 200 мг, для супоросных свиней - 60 мг.
В четыре пробирки налить по 5-6 капель кислот: 2н раствора HCl, 2н раствора H 2 SO 4 , концентрированной H 2 SO 4, 2н раствора азотной. В каждую пробирку внести кусочек железной стружки (или канцелярскую скрепку). Пробирку с концентрированной серной кислотой нагреть. Затем добавить во все растворы по одной капле 0,01н раствора роданида калия или аммония (KCNS или NH 4 CNS), которые образуют с ионами железа (III) соль Fe(CNS) 3 , интенсивно окрашенную в красный цвет. В каких кислотах образуются ионы Fe 3+ ?
В тех кислотах, где не произошло окрашивание раствора в красный цвет, при растворении железа образуются ионы Fe 2+ .
Дописать и уравнять реакции растворения железа в различных кислотах и указать в каждой из них окислитель:
а) Fe + HCl ® H 2 + ........
б) Fe + H 2 SO 4 (разб.) ® H 2 + ........
в) Fe + H 2 SO 4 (конц) ® SO 2 + H 2 O + ........
г) Fe + HNO 3 (разб.) ® NO + H 2 O + .......
Опыт 2. Получение гидроксида железа (II) и изучение его свойств.
Соли железа (II) вследствие частичного окисления на воздухе всегда содержат ионы железа (III). Поэтому для изучения свойств железа (II) следует брать наиболее устойчивую к окислению кристаллическую соль Мора /(NH 4) 2 SO 4 × Fe(SO 4) × 6H 2 O/ и для каждого опыта готовить свежий раствор, помещая несколько кристалликов её в 5-6 капель воды.
В три пробирки налить по 2 капли свежеприготовленного раствора соли Мора и добавлять по каплям 2н раствор щелочи (NaOH) до выпадения зеленовато-серого осадка Fe(OH) 2 . В одну из пробирок с осадком прибавить 2н раствора соляной кислоты до растворения его. Какие свойства (кислотные или основные) проявляет гидроксид железа (II) ? Осадок во второй пробирке оставить на воздухе на несколько минут, периодически встряхивая пробирку. В третью пробирку добавить 2-3 капли 3%-ного раствора перекиси водорода (Н 2 О 2). Отметить изменение цвета осадка от зеленоватого до бурого во второй и третьей пробирках вследствие образования гидроксида железа (III). В каком случае окисление произошло быстрее? Написать уравнения всех реакций: а) получения гидроксида железа (II); б) растворения осадка Fe(OH) 2 в соляной кислоте; в) окисления Fe(OH) 2 в Fe(OH) 3 кислородом воздуха с участием воды; г) окисления Fe(OH) 2 перекисью водорода.
Опыт 3. Восстановительные свойства железа (II) в кислой среде.
Поместить в пробирку 3 капли раствора перманганата калия (KMnO 4) и 2 капли 2н раствора серной кислоты. Внести в раствор несколько кристалликов соли Мора. Почему происходит обесцвечивание раствора? Что является восстановителем в данной реакции? Дописать уравнение реакции:
KMnO 4 + H 2 SO 4 + FeSO 4 ® MnSO 4 + K 2 SO 4 + H 2 O + .....
Опыт 4. Получение гидроксида железа (III) и изучение его свойств.
В две пробирки внести по 2 капли раствора соли железа (III) (FeCl 3 или Fe 2 (SO 4) 3) и по каплям раствора 2н NaOH до выпадения осадка (отметить цвет). В одну пробирку прилить 5-6 капель 2н раствора HCl или H 2 SO 4 , а в другую - столько же капель 2н раствора NaOH. Где произошло растворение осадка? Какие свойства (основные или амфотерные) имеет гидроксид железа (III)? Написать уравнения реакций.
Опыт 5. Окислительные свойства железа (III).
В пробирку с 3 каплями раствора соли железа (III) добавить 1-2 капли раствора иодида калия (KI). Отметить изменение окраски раствора. Какие свойства проявляет ион Fe 3+ ? Написать уравнение реакции, учитывая, что одним из продуктов реакции является I 2 .
Опыт 6. Гидролиз солей железа (II) и железа (III)
Поместить две полоски универсального индикатора на предметное стекло и нанести по 1 капле растворов соли Мора и хлорида железа (III) (раздельно). Определить рН растворов этих солей. Написать уравнения (ионные) реакций гидролиза этих солей по первой ступени. Какая соль подвергается гидролизу в большей степени? Какой гидроксид железа (II) или железа (III) имеет более основные свойства?
Опыт 7. Качественные реакции на ионы железа.
а) Реакция на ионы железа (II)
К 2-3 каплям раствора соли Мора добавить 1 каплю гексацианoферрата(III) калия (K 3 ). Отметить цвет осадка состава KFe. Написать уравнение реакции.
б) Реакция на ион железа (III)
К 2-3 каплям раствора хлорида железа (III) добавить 1 каплю разбавленного раствора роданида калия (KCNS) или аммония (NH 4 CNS). Отметить цвет полученного раствора роданида железа (III). Написать уравнение реакции.
Опыт 8. Получение гидроксидов кобальта (II), никеля (II) и изучение их свойств.
а) Внести в две пробирки по 2-3 капли раствора соли кобальта (CoCl 2) (цвет отметить) и добавлять в каждую по каплям раствор щелочи. Сначала появляется синий осадок основной соли Со(ОН)Сl, который затем меняет цвет на розовый вследствие образования гидроксида кобальта (II) (Со(ОН) 2) . Написать уравнения реакций образования гидроксида кобальта (II) по стадиям. Осадок в одной пробирке встряхнуть и оставить на воздухе на несколько минут. К осадку во второй пробирке добавить 2-3 капли 3%-ного раствора перекиси водорода. Отметить изменение цвета осадка. Написать уравнения реакций окисления Со(ОН) 2 в Со(ОН) 3 кислородом воздуха и перекисью водорода (Н 2 О 2). В каком случае окисление идет быстрее?
б) В три пробирки внести по 2-3 капли раствора соли никеля (цвет отметить) и по каплям добавлять раствор щелочи до выпадения осадка гидроксида никеля (II) (цвет отметить). Попробуйте окислить полученный гидроксид различными окислителями. Для этого осадок в первой пробирке оставить на воздухе, во вторую пробирку добавить 2-3 капли 3%-ного раствора Н 2 О 2 , в третью - 1 каплю бромной воды (Br 2 + H 2 O). В какой пробирке наблюдается изменение цвета осадка, т.е. идет окисление Ni(OH) 2 в Ni(OH) 3 ? Дописать уравнения реакций получения гидроксида никеля (II) и гидроксида никеля (III):
NiSO 4 + NaOH ® Na 2 SO 4 + .....
Ni(OH) 2 + Br 2 + NaOH ® NaBr + H 2 O + ...
Контрольные вопросы.
1.. Написать электронные формулы атомов железа, кобальта, никеля.
2. Какие степени окисления характерны для атомов элементов железа, кобальта, никеля?
3. Какое из веществ Fe(OH) 2 , Co(OH) 2 или Ni(OH) 2 является более сильным восстановителем? Вывод сделать на основании реакций этих гидроксидов с кислородом воздуха, Н 2 О 2 и Br 2 . (сила окислителя увеличивается в ряду О 2 ® Н 2 О 2 ® Br 2).
4. Написать уравнения реакций, при помощи которых можно различить ионы Fe 2+ и Fe 3+ .
5. Как получить из металлического железа соль железа (II)? Написать уравнение реакции.
6. Как получить из металлического железа соль железа (III)? Написать уравнение реакции.
7. Какая соль железа сильнее подвергается гидролизу: FeCl 2 или FeCl 3 ? Написать уравнения реакций гидролиза. Какая реакция среды растворов этих солей?
8. Как перевести соль железа (II) в соль железа (III)? Привести пример такого перехода.
9. Как перевести соль железа (III) в соль железа (II)? Привести пример такой реакции.
10. Могут ли существовать совместно: а) Fe(OH) 2 и H 2 O 2 ?;
б) Ni(OH) 2 и Н 2 О 2 ? Почему? Если идет реакция, то написать её.
11. Могут ли существовать совместно: а) Ni(OH) 2 и Br 2 ?;
б) FeCl 3 и KI ? Если идут реакции, то написать их.
12. Какой гидроксид Fe(OH) 2 или Ni(OH) 2 может окислиться кислородом воздуха? Если реакция идёт, написать её.
13. На чистую поверхность сплава нанесли 1-2 капли концентрированной кислоты и через 2-3 мин. к капле приложили фильтровальную бумагу, смоченную раствором KCNS. На бумаге появилось красное пятно. Какой металл присутствует в сплаве? Написать реакцию.
14. Как можно получить в лаборатории Со(ОН) 3 и Ni(OH) 3 ? Написать уравнения реакций.
15. При насыщении хлором гидроксида железа(III), взвешенного в растворе гидроксида калия образуется феррат калия. Написать уравнение реакции.
16. Написать уравнения реакций: а) между ферратом бария и концентрированной соляной кислотой; б) между ферратом калия и иодидом калия.
17. Что происходит при добавлении раствора карбоната натрия а) к раствору сульфата железа (II); б) к раствору сульфата железа (III)? Чем вызывается различие в характере образующихся продуктов? Написать уравнения реакций.
18. Написать уравнения реакций, которые могут протекать при действии раствора сульфида натрия а) на раствор хлорида железа(II): б) на раствор хлорида железа(III). Можно ли полученный осадок растворить в избытке соляной кислоты?
19. Какие соединения образуют железо, кобальт, никель с монооксидом углерода? В каких условиях их получают?
20. Привести примеры реакций получения ферритов. Что происходит при добавлении к ферриту натрия избытка воды. Написать уравнения реакций.
ХИМИЯ НЕМЕТАЛЛОВ
Бор (В) и алюминий входят в главную подгруппу III группы периодической системы. На внешнем электронном слое атомов три электрона:
Поскольку на предпоследнем уровне бора всего два электрона, его свойства резко отличаются от свойств других элементов подгруппы - он единственный неметалл в III A подгруппе. Хотя формально бор проявляет степень окисления +3 в оксидах и галогенидах, однако ион В +3 неизвестен. В образовании ковалентных связей с неметаллами участвуют три sp 2 -гибридных облака возбужденного атома бора, поэтому соединения бора со степенью окисления +3 имеют плоско - треугольное строение.
В соединениях с металлами - боридах - бор является акцептором электронов: Mg 3 B 2 , AlB и др.
При обычных условиях простое вещество бор - твердое вещество (t пл = 2075 °С). Кристаллическое строение бора особенное. Оно не является характерным ни для металлов, ни для неметаллов. В нем реализуется большее число связей (>4), природа которых не является ни типично металлической, ни обычной ковалентной. Кристалл бора состоит из икосаэдров - правильных двадцатигранников с 12 вершинами. При обычных температурах бор весьма инертен. При высоких температурах он становится активным, взаимодействует с кислородом, галогенами, серой, азотом, углеродом, водородом и многими металлами.
Бор медленно реагирует с такими сильными окислителями, как фтор, горячая концентрированная азотная кислота и царская водка. Аморфный бор постепенно растворяется при кипячении в концентрированной щелочи:
2B + 2NaOH + 2H 2 O = 2NaBO 2 + 3H 2
Диаграмма Латимера для бора:
1- -1,822
Триоксид бора В 2 О 3 - кислотный оксид. Известны три его гидратные формы - борные кислоты Н 3 ВО 3 – ортоборная кислота
НВО 2 – метаборная кислота
Н 2 В 4 О 7 – тетраборная кислота
Возможно, будет полезно почитать:
- Патриарх кирилл запретил актеру и священнику ивану охлобыстину служить в церкви Охлобыстин церковный сан ;
- Иван охлобыстин - биография, информация, личная жизнь Почему охлобыстин ушел из священников ;
- Ужин для ребенка 4 лет рецепты меню ;
- Принципы функционирования бюджетной системы РФ ;
- Особенности размещения населения на территории земли Население земли размещается равномерно средняя плотность населения ;
- Тонька-пулеметчица — cтрашная судьба страшного человека Фильм палач тонька пулеметчица реальная история ;
- Как поздравить начальницу с юбилеем? ;
- Российские студенты выиграли чемпионат мира по программированию Вот они, герои ;