Взаимодействие железа с растворами солей. Химическое и физические свойства железа
– составная гемоглобина. Этот сложный белок входит в эритроциты, известные так же как красные кровяные тельца. Без них, собственно, кровь не была бы алой, да и жизни бы не было.
Эритроциты транспортируют по организму углекислый газ и кислород. Они необходимы для жизнедеятельности. А для чего еще необходимо железо , каковы его свойства и стоимость в прямом и переносном смыслах?
Химические и физические свойства железа
Дотрагивались до железа в прохладном помещении? Холод от прикосновения к металлу – результат его высокой теплопроводности. Материал моментально забирает энергию тела, передавая ее окружающей среде. В результате, человеку становится холодно.
Электропроводность железа тоже на высоте. Металл с легкостью передает ток благодаря свободным электронам в атоме. В нем 7 слоев. На последних 2-х расположены 8 электронов. При возбуждении все они могут быть валентными, то есть способными образовать новые связи.
Внешне металл железо серебристо-серый. Встречаются самородные формы. Чистое железо пластичное и ковкое. У выраженный металлический блеск и средняя твердость – 4 балла по . 10 баллов – показатель самого твердого на земле камня алмаз, а 1-им баллом отмечен тальк.
Железо – элемент средней тугоплавкости. Закипает металл при 2860-ти градусах, а размягчается при 1539-ти. В таком состоянии материал теряет ферромагнитные свойства. Они присущи лишь твердому состоянию железа. Элемент становится магнитом, попадая в поле.
Но, интереснее то, что после его исчезновения, металл еще долгое время остается магнитом. Такая особенность обусловлена все теми же свободными электронами в структуре атома. Перемещаясь, частицы меняют его строение и свойства.
Железо – химический элемент , легко вступающий в реакции с бромом, фтором, хлором и другими галогенами. Это элементы 17-ой группы таблицы Менделеева. При обычных условиях протекает и взаимодействие с кислородом.
Теперь, о реакциях нагрева. При сжигании металла образуются его оксиды. Их несколько видов: — 2FeO, 2Fe 2 O 3 , Fe 3 O 4 . Какой именно получится, зависит от пропорций исходных элементов и условий совмещения. Свойства оксидов разнятся.

Нагрев запускает и реакцию с . Для нее нужно 6 молей железа и один моль газа. Выход – 2 моля нитрида 26-го элемента. Его фосфид формируется уже в сочетании с фосфором. Еще одно простое вещество, объединяющееся с феррумом – . Получается, естественно, сульфид. Протекает реакция присоединения.
Из сложных веществ, то есть состоящих из молекул, железо взаимодействует с кислотами. Металл вытесняет из них водород. Получается замещение. Так, и взаимодействия с серной кислотой выходит сульфат феррума и чистый водород.
Возможны и реакции с . Их железо восстанавливает. Иными словами, 26-ой элемент выделяет из веществ менее активный металл. Соединив феррум, к примеру, с сульфатом меди, получают сульфат уже железа. остается в первозданном виде.
Применение железа
Где железо применяется, вытекает из его свойств. Ферромагнитоность пригождается при изготовлении сувениров и промышленных установок. Иными словами, из металла делают магниты, как для холодильников, так и для больших производств. Прочность материала, твердость – повод использовать его для изготовления оружия, брони.
Особым шиком считаются модели из метеоритного железа . В космических телах свойства феррума усилены. Поэтому, ножи и доспехи получаются особенно острыми, прочными. Признаки железа метеоритного заметили еще в Древнем Риме.
Известны и сплавы железа , в частности, чугун и сталь. Из них отливают вещи бытового, повседневного характера, к примеру, оградки, беседки, фурнитуру. Используют феррума и для промышленных целей. Интересно, что состав у стали и чугуна один, пропорции разные. И там, и там сливаются железо с углеродом . В стали газа меньше 1,7%. В чугуне углерода от 1,7 до 4,5%.

Углерод в сплавах железа играет роль упрочняющего элемента. Он снижает подверженность смеси коррозии и делает материал термоустойчивым. К сталям примешивают и иные добавки. Не зря существуют разные марки сплава. С , к примеру, производят стойкую к ударам и, при этом, пластичную сталь.
В виде хлорида 26-ой элемент используют для очистки воды. Пригождается металл и в медицине. Лечение железом необходимо при анемии. Это недостаток красных кровяных телец и металла в их составе. Препараты железа выписывают, так же, больным туберкулезом, радикулитом, страдающим от судорог и кровотечений из носа.
26-ой элемент необходим и для нормального функционирования щитовидной железы. Обычно, ее дисфункцию связывают с дефицитом . Однако, не он один обеспечивает здоровье железы.
Немало феррума и в клетках печени. Там металл способствует нейтрализации вредных веществ, токсинов. Для поддержания в организм человека должны поступать не меньше 20-ти миллиграммов железа в сутки.
Добыча железа
Железо – распространенный металл. В природе немало минералов, в основе которых лежит 26-ой элемент. Больше всего феррума в и . Из них-то и удаляют железо .
Проводится реакция восстановления металла. Для того нужен кокс, то есть соединение углерода. Взаимодействие протекает при температуре в 2000 градусов Цельсия, в доменных .
Без доменных печей обходятся при восстановлении феррума чистым водородом. Потребуются уже шахтные печи. Так называют модели вытянутые по вертикали.

Рабочее пространство аппарата подобно цилиндру или конусу. В них помещают измельченную руду железа , смешанную со специальной . Потом, добавляют водород. Итог все тот же – чистый феррум.
Цена железа
Стоимость металла зависит от вида продукции. Большинство вещей делаются из сплавов феррума, к примеру, кровельные материалы. Покрытия для крыш, как правило, листовые. Цена за квадратный метр варьируется от 300-от до 600-от с лишним рублей в зависимости от толщины железа.
Кровельные листы рифленые, сложной геометрии и особого состава. Простые пласты стоят дешевле. Есть предложения купить 30 листов 2,5 на 1,3 метра за 1000 рублей. Толщина – 1,5 миллиметра.
Чистый элемент в таблетках стоит около 1600 рублей за 180-200 штук. Если же приобретается готовое изделие, в которое вложен ручной труд, бывает сложно уложиться и в десятки, сотни тысяч. Яркий пример – кованная продукция по индивидуальным заказам.
За необычные ворота, мебель, вазы, кузнецы «срывают» немалый куш. Большую часть цены составляет не материал, а человеческий труд, воплощение в жизнь задумки.

Что касается стоимости железосодержащей руды, за тонну в России просят около 40-ка американских долларов. Это ценник за сырье с 60-процентным содержанием феррума. Когда выделяют чистый порошок 26-го элемента, за 1000 килограммов просят уже не меньше 560-600-от долларов США.
Большинство фирм торгуют оптом. Предложений купить только одно кило металла, редки. 1000 граммов обходится примерно в 1-1,5 доллара. Некоторые компании фасуют порошок феррума в мешки по 5, 10, 25 килограммов. Объявления о продаже размещены в интернете.
Описание:
Рассмотрим химические свойства железа. В таблице Д.И. Менделеева элемент железо имеет порядковый номер 26 и находится в четвертом периоде, VIII B группе.
Заряд ядра атомов железа Fe равен +26, вокруг ядра вращается 26 электронов. Графическая электронная формула железа выглядит следующим образом (см. рисунок)
Так как железо относится к d-элементам, то для него валентными являются не только s-электроны внешнего слоя, но и неспаренные 3d-электроны предвнешнего слоя. Поэтому возможные значения валентности Fe в соединениях могут быть равны 2, 3, 4, 5 или 6. Чаще всего при образовании связей по обменному механизму Fe проявляет валентность 2 или 3. Соединения, в которых железо по обменному механизму образует 4, 6 и особенно 5 связей, являются немногочисленными и малоустойчивыми.
Как и все металлы, при взаимодействии с неметаллами Fe выступает в роли восстановителя и проявляет только положительную степень окисления: чаще всего +2 или +3, значительно реже +4, +6 и особенно +5.
Соединения, в которых железо проявляет степень окисления +4, +6 или +5 обладают сильными окислительными свойствами и легко восстанавливаются до соединений, где степень окисления Fe равна +3.
Соединения железа со степенью окисления +2, наоборот, обладают восстановительными свойствами и уже на воздухе медленно окисляются Fe +3 . В связи с этим длительное время они могут существовать только в инертной среде.
Наиболее устойчивыми являются вещества, где степень окисления железа равна +3. Это объясняется образованием энергетически выгодной электронной конфигурации ионов железа Fe 3+ , в которой 3d-подуровень становится наполовину заполненным за счет распаривания своей электронной пары.
Ион Fe 3+ имеет на 3d-подуровне 5 неспаренных электронов, способных участвовать в образовании химических связей, поэтому сильными окислителями он максимально может быть окислен до Fe +8 .
В водном растворе могут присутствовать только простые ионы Fe 2+ или Fe 3+ . Атомы железа с более высокой степенью окисления входят в состав сложных ионов.
Для ионов Fe 2+ и Fe 3+ характерна высокая склонность к комплексообразованию за счет образования ковалентных связей по донорно-акцепторному механизму. Чаще всего в таких комплексных ионах ( 4- , 3- , 3+) железо образует 6 связей, выступая в роли акцептора электронной пары.
В химическом плане железо является металлом средней активности. При взаимодействии со слабыми окислителями образуются производные двухвалентного железа (со степенью окисления +2), а сильные окислители окисляют его до +3.
Химическая активность железа сильно зависит от степени его чистоты, дисперсности, присутствия влаги и кислорода. При хранении на воздухе (в отсутствии влаги) оно покрывается плотной оксидной пленкой. При нагревании (t > 200 о С) скорость реакции существенно ускоряется. В зависимости от условий образуется или оксид Fe 2 O 3 (при сгорании на воздухе при t < 570 о С)
4Fe + 3О 2 -- 2Fe 2 О 3
или смешанный оксид Fe 3 О 4 (FeО ∙ Fe 2 О 3), называемый железной окалиной (сгорание в атмосфере кислорода при t > 570 о С)
3Fe + 2О 2 --Fe 3 О 4
При хранении в присутствии влаги железо (особенно содержащее примеси менее активных металлов) интенсивно подвергается электрохимической коррозии. Этот процесс можно упрощенно представить следующим образом:
4Fe + 3О 2 + 6Н 2 О = 4Fe(ОН) 3
Fe(ОН) 3 = FeО(ОН) + Н 2 О
При взаимодействии с галогенами железо образует соли соответствующих бескислородных кислот. Фтор и хлор (как сильные окислители) окисляют железо до +3.
2Fe + 3F 2 = 2FeF 3
2Fe + 3Cl 2 -- 2FeCl 3
Бром, в зависимости от условий проведения реакции, окисляет железо как до +2, так и до +3.
При взаимодействии с I 2 (как более слабым окислителем) железо окисляется только до +2.
Fe + I 2 -- FeI 2
При нагревании с серой образуется железо(II)-сульфид
В расплавленном состоянии железо реагирует с углеродом, фосфором, кремнием, бором, азотом, образуя соединения нестехиометрического состава (например, цементит Fe 3 С), которые можно рассматривать как сплавы.
Как и все металлы, железо реагирует с растворами кислот. Кислоты, у которых в роли окислителя выступают ионы Н + , окисляют железо до +2 и выделяют при этом Н 2:
Fe + 2HCl = FeCl 2 + H 2
Fe + H 2 SO 4 разб. = FeSO 4 + H 2
Концентрированные H 2 SO 4 и HNO 3 на холоде и при обычных условиях на железо не действуют из-за эффекта пассивации, но при нагревании реакция становится возможной (железо при этом окисляется до Fe 3+):
2Fe + 6H 2 SO 4 конц. -- Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe + 6НNO 3 конц. -- Fe(NO 3) 3 + 3NO 2 + 3Н 2 О
Причем, чем более концентрированной является кислота, тем выше температура реакции. Например, чистая 100% H 2 SO 4 не взаимодействует с железом вплоть до температуры кипения.
При нагревании железо реагирует с Н 2 О:
3Fe + 4H 2 O -- Fe 3 O 4 + 4H 2
Железо вытесняет из водных растворов солей менее активные металлы, окисляясь при этом, как правило, до Fe 2+ .
Fe + CuSO 4 = Cu + FeSO 4
Fe + 2AgNO 3 = 2Ag + Fe(NO 3) 2
Fe + HgCl 2 = Hg + FeCl 2
При нагревании железо может восстанавливать из оксидов те металлы, которые обладают меньшим, чем Fe, сродством к кислороду.
Первые изделия из железа и его сплавов были найдены при раскопках и датируются примерно 4 тысячелетием до нашей эры. То есть еще древние египтяне и шумеры использовали метеоритные месторождения данного вещества, чтобы изготовлять украшения и предметы быта, а также оружие.
Сегодня соединения железа различного рода, а также чистый металл - это самые распространенные и применяемые вещества. Не зря XX век считался железным. Ведь до появления и широкого распространения пластика и сопутствующих материалов именно это соединение имело для человека решающее значение. Что представляет собой данный элемент и какие вещества образует, рассмотрим в данной статье.
Химический элемент железо
Если рассматривать строение атома, то в первую очередь следует указать его местоположения в периодической системе.
- Порядковый номер - 26.
- Период - четвертый большой.
- Группа восьмая, подгруппа побочная.
- Атомный вес - 55,847.
- Строение внешней электронной оболочки обозначается формулой 3d 6 4s 2 .
- Символ химического элемента - Fe.
- Название - железо, чтение в формуле - "феррум".
- В природе существует четыре стабильных изотопа рассматриваемого элемента с массовыми числами 54, 56, 57, 58.
Химический элемент железо имеет также около 20 различных изотопов, которые не отличаются стабильностью. Возможные степени окисления, которые может проявлять данный атом:
Важное значение имеет не только сам элемент, но и его различные соединения и сплавы.
Физические свойства
Как простое вещество, железо имеет с ярко выраженным металлизмом. То есть это серебристо-белый с серым оттенком металл, обладающий высокой степенью ковкости и пластичности и высокой температурой плавления и кипения. Если рассматривать характеристики более подробно, то:
- температура плавления - 1539 0 С;
- кипения - 2862 0 С;
- активность - средняя;
- тугоплавкость - высокая;
- проявляет ярко выраженные магнитные свойства.
В зависимости от условий и различных температур, существует несколько модификаций, которые образует железо. Физические свойства их различаются от того, что разнятся кристаллические решетки.
Все модификации имеют различные типы строения кристаллических решеток, а также отличаются магнитными свойствами.
Химические свойства
Как уже упоминалось выше, простое вещество железо проявляет среднюю химическую активность. Однако в мелкодисперсном состоянии способно самовоспламеняться на воздухе, а в чистом кислороде сгорает сам металл.
Коррозионная способность высокая, поэтому сплавы данного вещества покрываются легирующими соединениями. Железо способно взаимодействовать с:
- кислотами;
- кислородом (в том числе воздухом);
- серой;
- галогенами;
- при нагревании - с азотом, фосфором, углеродом и кремнием;
- с солями менее активных металлов, восстанавливая их до простых веществ;
- с острым водяным паром;
- с солями железа в степени окисления +3.
Очевидно, что, проявляя такую активность, металл способен образовывать различные соединения, многообразные и полярные по свойствам. Так и происходит. Железо и его соединения чрезвычайно разнообразны и находят применение в самых разных отраслях науки, техники, промышленной деятельности человека.
Распространение в природе
Природные соединения железа встречаются довольно часто, ведь это второй по распространенности элемент на нашей планете после алюминия. При этом в чистом виде металл встречается крайне редко, в составе метеоритов, что говорит о больших его скоплениях именно в космосе. Основная же масса содержится в составе руд, горных пород и минералов.

Если говорить о процентном содержании рассматриваемого элемента в природе, то можно привести следующие цифры.
- Ядра планет земной группы - 90%.
- В земной коре - 5%.
- В мантии Земли - 12%.
- В земном ядре - 86%.
- В речной воде - 2 мг/л.
- В морской и океанской - 0,02 мг/л.
Самые распространенные соединения железа формируют следующие минералы:
- магнетит;
- лимонит или бурый железняк;
- вивианит;
- пирротин;
- пирит;
- сидерит;
- марказит;
- леллингит;
- миспикель;
- милантерит и прочие.
Это еще далеко список, ведь их действительно очень много. Кроме того, широко распространены различные сплавы, которые создаются человеком. Это тоже такие соединения железа, без которых сложно представить современную жизнь людей. К ним относятся два основных типа:
- чугуны;
- стали.
Также именно железо является ценной добавкой в составе многих никелевых сплавов.
Соединения железа (II)
К таковым относятся такие, в которых степень окисления образующего элемента равна +2. Они достаточно многочисленны, ведь к ним можно отнести:
- оксид;
- гидроксид;
- бинарные соединения;
- сложные соли;
- комплексные соединения.
Формулы химических соединений, в которых железо проявляет указанную степень окисления, для каждого класса индивидуальны. Рассмотрим наиболее важные и распространенные из них.

Общие сведения
Железо (лат. Ferrum), химический элемент VIII группы периодической системы Менделеева. Порядковый номер 26, атомная масса 55,847. Блестящий серебристо-белый металл. Элемент в природе состоит из четырех стабильных изотопов: (5,84%), (91,68%), (2,17%) и (0,31%).
Историческая справка. Железо было известно еще в доисторические времена, однако широкое применение нашло значительно позже, так как в свободном состоянии встречается в природе крайне редко, а получение его из руд стало возможным лишь на определенном уровне развития техники. Вероятно, впервые человек познакомился с метеоритным Железом, о чем свидетельствуют его названия на языках древних народов: древнеегипетское "бени-пет" означает "небесное железо"; древнегреческое sideros связывают с латинским sidus (род. падеж sideris) – звезда, небесное тело. В хеттских текстах 14 века до н. э. упоминается о Железе как о металле, упавшем с неба. В романских языках сохранился корень названия, данного римлянами (например, франц. fer, итал. ferro).
Химические свойства железа и его соединений
Железо – это химический элемент №26, который находится в побочной подгруппе VIII группы, в четвертом периоде. Электронная конфигурация атома железа .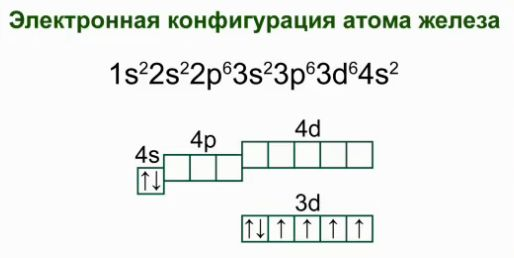
Степени окисления железа: 0,+2,+3.
Соединения железа (III) проявляют слабые окислительные свойства, образуемые оксиды и гидроксиды и проявляют амфотерные свойства, хотя основные свойства у этих соединений значительно преобладают.
1. Взаимодействие с неметаллами.
При нагревании железо особенно порошкообразное способно взаимодействовать практически со всеми неметаллами. Хлор и фтор окисляют железо до , бром может окислить и до и до в зависимости от количества, а йод окисляет только до степени окисления +2 . При реакции с серой сначала образуется сульфид железа, а затем дисульфид железа.
→
→
природный минерал такого состава называется пирит.
Он используется для получения серной кислоты, а также железа и соединений железа.
2. Взаимодействие железа с кислородом.
При взаимодействии железа с кислородом в зависимости от его количества, могут образовываться разные оксиды. В том числе и смешанный оксид .
→
→
→
3. Взаимодействие железа с водой.
При сильном нагревании металлическое железо взаимодействует с водой.![]() →
→![]()
Во влажном воздухе при обычных условиях железо реагирует с парами воды и кислородом, с образованием ржавчины. Она состоит из смешенных оксидов, гидроксидов и соединений кислорода. Это не индивидуальное вещество.
Примерная схема ржавления железа:![]() →
→
4. Взаимодействие железа с кислотами.
Как и другие типичные металлы, железо взаимодействует с кислотами не окислителями с выделением водорода.
→
С кислотами окислителями железо не реагирует из-за пассивации. Но с разбавленными кислотами реакция происходит.![]() →
→ 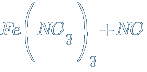
5. С растворами солей.
Металлическое железо вытесняет менее активные металлы из растворов их солей.![]() →
→ ![]()
Амфотерные свойства железа.
Железо и некоторые его соединения способны проявлять амфотерные свойства.
→ ![]()
В горячем концентрированном растворе щелочи образуется комплексное соединение и выделяется водород.
Соединения железа(II)
Соли железа (II) можно получить при взаимодействии металлического железа с кислотами не окислителями или восстановлением железа(III).
![]() →
→
Соединения железа(II) обладают восстановительными свойствами.![]() → ↓.
→ ↓.
На воздухе ↓окисляется кислородом.
↓![]() → ↓
→ ↓
Соединения железа(III)
Соли железа(III) получают либо окислением железа галогенами, либо при его взаимодействии с разбавленными кислотами окислителями. Соли железа(III) могут проявлять слабые окислительные свойства.
![]() →
→ ![]() ↓ .
↓ .
На этой реакции основан йодометрический способ определения солей железа.
Качественная реакция на соли железа(III)
![]() →
→![]() .
.
При взаимодействии с роданидами образуются ярко-красные похожие на кровь комплексы различного состава.
Взаимодействие со щелочью.![]() → ↓
→ ↓
↓как и ↓ амфотерен, с преобладание основных свойств.
↓ → ![]()
→ ![]()
Железная кислота и её соли.
При окислении ↓ или при электролизе раствора щелочи на железном аноде образуются соли, содержащие железо в составе аниона:![]() →
→![]() →
→ ![]()
Железо имеет степень окисления +6 .Такие соли называются ферраты: ![]() . Это соли несуществующей в свободном виде железной кислоты . Они относятся к наиболее сильным органическим окислителям и способны медленно окислять даже воду.
. Это соли несуществующей в свободном виде железной кислоты . Они относятся к наиболее сильным органическим окислителям и способны медленно окислять даже воду.
Значение переходных металлов для организма и жизнедеятельности
Без переходных металлов наш организм существовать не может. Железо – это действующее начало гемоглобина. Цинк участвует в выработке инсулина. Кобальт – центр витамина В-12. Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов.
Многие переходные металлы и их соединения используются в качестве катализаторов. Например, реакция гидрирования алкенов на платиновом или палладиевом катализаторе. Полимеризация этилена проводится с помощью титансодержащих катализаторов.
Большое использование сплавов переходных металлов: сталь, чугун, бронза, латунь, победит. 
При исследовании сплавов прослеживается уникальное значение железа для человека. Сплавы даже разделяют на черные и цветные по содержанию в них железа.
Возможно, будет полезно почитать:
- Патриарх кирилл запретил актеру и священнику ивану охлобыстину служить в церкви Охлобыстин церковный сан ;
- Иван охлобыстин - биография, информация, личная жизнь Почему охлобыстин ушел из священников ;
- Ужин для ребенка 4 лет рецепты меню ;
- Принципы функционирования бюджетной системы РФ ;
- Особенности размещения населения на территории земли Население земли размещается равномерно средняя плотность населения ;
- Тонька-пулеметчица — cтрашная судьба страшного человека Фильм палач тонька пулеметчица реальная история ;
- Как поздравить начальницу с юбилеем? ;
- Российские студенты выиграли чемпионат мира по программированию Вот они, герои ;