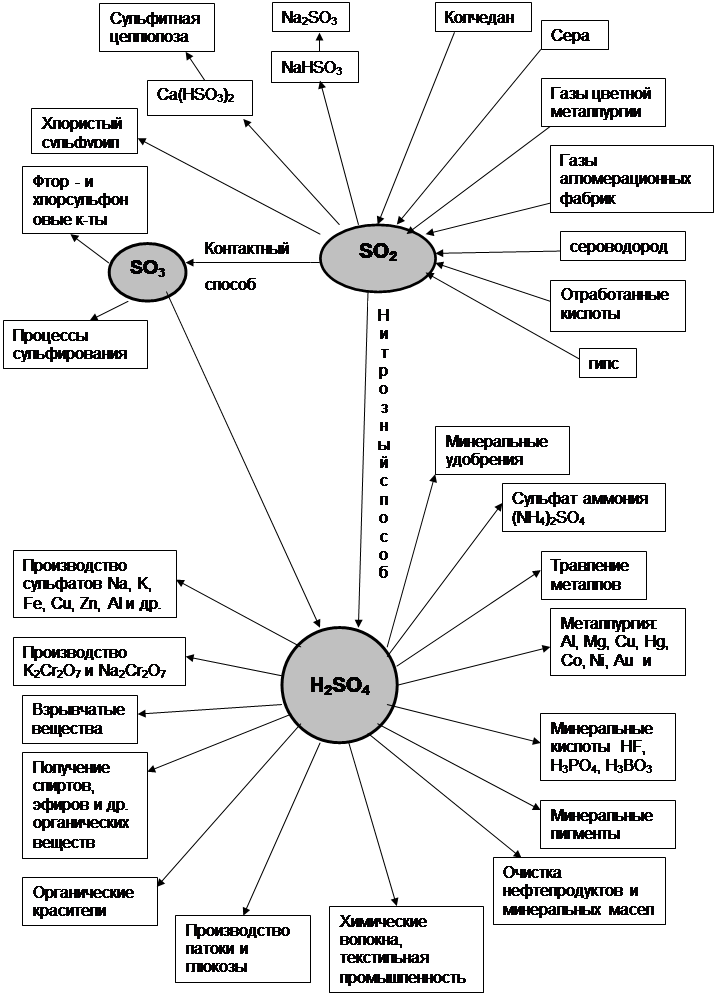
Схема получения серной кислоты контактным способом. Контактный метод получения серной кислоты
В 13 веке серную кислоту получали обжигом медного купороса. Отсюда старинное название серной кислоты - купоросное масло. С 18 века серную кислоту получаю нитрозным способом, который сохранился до сих пор. На территории нашей области получали серную кислоту. В нашей стране существует 2 основных способа получения серной кислоты: нитрозный и контактный. По любому из способов первая стадия - окисления серосодержащего сырья кислородом воздуха с получением оксида серы (IV). Его окисляют в SO3. В нитрозном способе катализаторы оксиды азота в башнях, в жидкой фазе. Ее концентрация 75%. Она содержит большое количество примесей. Является очень дешевой и идет на производство удобрений. В экологическом плане производство башенной кислоты является очень грязным. В настоящее время новые установки больше не строят, но старые установки будут существовать долго из-за дешевизны получаемой кислоты.
В контактном способе для окисления SO2 в SO3 используется твердый катализатор. На последней стадии S03 взаимодействует с водой с образованием серной кислоты. Данный способ в экологическом отношении является чистым.
Теоретические основы получения серной кислоты контактным способом.
Процесс состоит из 4 стадий:
1. Обжиг серного колчедана.
2. Очистка печного газа от каталитических ядов.
3. Каталитическое окисление SO2 в SO3.
4. Абсорбция SO3 98% серной кислотой или олеумом.
Получение SO2. Получают обжигом пирита, входящего в состав сетного колчедана кислородом воздуха.
4FeS2 + 11O2 ---(600-800С)---> 2Fe2O3 + 8SO2 + теплота
Это гетерогенная, высокотемпературная реакция, необратимая, некаталитическая. Во время обжига на поверхности частичек пирита образуется сой оксида железа, которое препятствует реакции окисления. Скорость гетерогенной реакции зависит от поверхности раздела фаз. Необходимо измельчить пирит. Во время процесса толщина оксидной пленки постоянно увеличивается и препятствует дальнейшей реакции окисления, процесс переходит во внутридиффузионную область. Для снятия этих диффузионных торможений пирит необходимо измельчать, при этом толщина оксидной пленки автоматически уменьшается.
При переходе к микротелам микрочастицы пирита при температуре выше 900 градусов начинают сплавлятся с образованием крупных агломератов. Поэтому температуру ограничивают 600-900 градусов.
Процесс диффузии на поверхности пирита протекает следующим образом: молекулы кислорода затекают внутрь зерна пирита и вступают в реакцию с образованием оксида железа и SO2. Образовавшейся SO2 десорбируется из частиц пирита с образованием вокруг частички облака SO2, которое мешает проникновение кислорода внутрь частицы пирита. Для устранения этого недостатка частицы пирита необходимо энергично перемешивать.
Очистка печного газа.
Полученный печной газ сначала охлаждается от основного количества пыли в циклоне, после охлаждения идет.....
В печном газе после охлаждение содержится большое количество примесей - селен, мышьяк, оксиды железа, влага и т.д.
Многие примеси являются контактными ядами окисления SO2 в SO3. Поэтому требуется очистка и осушка печного газа.
На сегодняшний день эффективно можно провести только мокрую очистку.
Вредные примеси последовательно поглощаются 70%, 35%, 5% серной кислотой и водой. После этого производится осушка производимой серной кислотой, которая после этого отбирается как товарный продукт.
Проблемная ситуация: на стадии очистки печной газ охлаждают, увлажняют, а на следующей стадии его придется нагревать до высокой температуры и осушать.
Окисление SO2 в SO3.
Это экзотермическая каталитическая обратимая реакция, протекающая с уменьшением объема.
2SO2 + О2 = 2SO3 + Q
Согласно принципа Ле Шателье ее надо вести при пониженной температуре и повышенном давлении. В насточящее время данный процесс ведется без применения давления из-за большой концентрации баласта азота.
Без катализатора данная реакция практически не идет.используются следующие катализаторы - платина - очень активна, но очень доргой катализатор, сильно отравляется контактными ядами; оксид ванадия - активен при температуре 400-600 градусов, сабо травится контактными ядами, является основным катализатором; оксид железа 3 - дешевый, не травится контактными ядами, но активен при температуре выше 625 градусов, при которой равновесная степень превращения не может быть выше 70%. Применяется для предвпрително окисления SO2 в SO3 со степенью превращения 50-60%.
Влияние температуры.
В процессе окисления непрерывно выделяется тепло, что приводит к непрерывному повышению температуры в реакторе. Для того, чтобы выдерживать температурный режим в реакторе реактор делают многоступенчатым и после каждой ступени производится отвод тепла.
Равновесная степень превращения. Для того, чтобы сместить степень равновесия вправо и достичь общей степени превращения близкой к 100% разработана система ДК/ДА - двойное контактирование и двойная абсорбция. После первой ступени контактирования (1-3 полка реактора, всего 5) контактный газ идет на абсорбцию для извлечения из него образовавшегося SO3. Равновесная степень превращения на этой ступени состовляет 93%. Оставшийся SO2возвращается в реактор на 2 ступень контактирования (4-5 полка реактора), где снова на 93% SO2 превращается в SO3. И далее идет на вторую ступень абсорбции. Общая степень превращения состовляет: 99,5%.
Абсорбция оксида серы VI.
SO3 + H2O --> H2SO4 + Q
Из-за возможности образования тумана..в качестве абсорбента нельзя использовать воду, используют 98% серную кислоту (упругость паров равна 0) или 19% олеум.
Данная реакция является гетерогенной, поэтому необходимо увеличение поверхности раздела фаз между газовой и жидкой фазами. Для этого используются тарелки и очень высокая плотность орошения колонны. Орошение ведут 19% олеумом, получают 20% олеум. Данную реакцию можно провестив паровой фазе с очень высокой скоростью, при этом необходимо осаждать туман серной кислоты на электрофильтрах.
Конструкция аппаратуры при этом очень сильно упращается.
Абсорбция практически необратима при температуре выше 500 градусов.
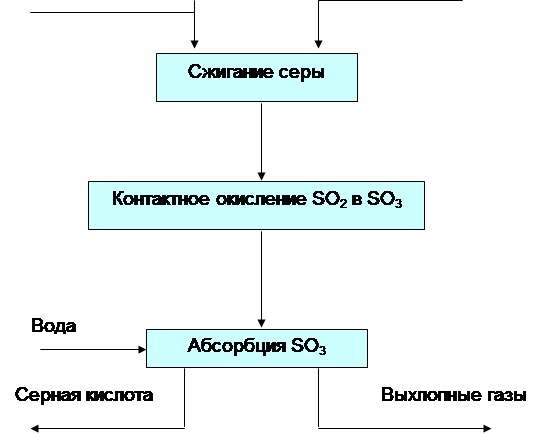
Технологическая схема получения серной кислоты контактным способом методом ДК/ДА.
Получают непрерывным методом в 4 стадии.
1. Окисление серного колчадана кислородом воздуха до оксида серы 4.
2. Мокрая очистка оксидов серы 4 от контактных ядов.
3. Контактное окисление оксида серы4 в оксид серы 6 на гетерогенном ванадиевом катализаторе.
4. Абсорбция оксида серы 6 98% серной кислотой и олеумом.
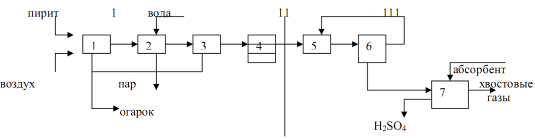
В печи киящего слоя 1 непрерывно подается измельченный серный колчадан и воздух (избыток 1,5). Полученный печной газ очищается от пыли в циклоне 2, охлаждается в котле-утилизаторе 3, проходит электрофильтр 4 для удаления остатков пыли и далее поступают на мокрую очистку. Мокрая очистка является дорогой, но только она на сегодняшний день способна очистить печной газ от контактых ядов - оксидов селена, мышьяка, паров воды. Мокрая очистка осуществляется в промывных баш7ях, мокрых электрофильтрах и в сушильных башнях. Для этого печной газ последовательно проходит промывные башни 5,6,8, которые орошаются 70% серной кислотой (5), 35% серной кислотой (6), 5% серной кислотой и водой (8).После башен 6 и 8 устанавливаютс мокрые электрофильтры 7 и 9. 75% серная кислота, выходящая снизу из промывной башни 5 идет на выделение шлама, из которого выделяют селен и мышьяк. Селен идет на производство полупроводников. 75% кислота, а также водные растворы серной кислоты, которые отводятся с колон 6 и 8 и электрофильтров 7 и 9 идут на производство минеральных удобрений. Электрофильтры 7 и 9 используются для уничтожения тумана серной кислоты.Очищенный таким образом печной газ из электрофильтра 9 поступает в нижнюю часть абсорбционной колонны 10, где с помощью 96-98% кислоты производится осушка печного газа. Снизу колонны отводится товарная серная кислота с концентрацией 93-95%.
Очищенный и осушеный печной газ с помощью компрессора 11 через фильтр 12 подается в систему теплоообменников (13 и 14) для подогрева до температуры 400 градусов и подается в контактный аппарат 15, состоящий из 5 слоев катализатора. Первые 3 слоя используются для первого этапа контактирования, 4 и 5 для второго этапа контактирования. Исходная концентрация SO2 в печном газе составляет 10%. Подогрев печного газа в теплоообменниках 13 и 14 осуществляется за счет контактного газа, который отбирается после 1 и 3 слоя катализатора. Степень превращения SO2 в SO3 на первом слое катализатора достигает 70%, температура контактного газа повышается до 600 градусов. Он проходит трубное прстранство теплообменника 14 и с температурой 400 градусов поступает на 2 слой катализатора. После 2 слоя контактный газ охлаждается в теплообменике 18 и поступает на 3 слой катализатора. После него контактный газ охлаждается в трубном пространстве теплообменника 13 и направляется на первую ступень абсорбции для извлечения образовавшегося SO3. Абсорбция осуществляется последовательно в2-х абсорберах 16 и 17. 16 абсорбер орошается в верхней части 19% олеумом, снизу его отводится 20% олеум. Это основной товарный продукт установки. Из 16 абсорбера контактный газ далее направляется в нижнюю часть 17 абсорбера, который орошается 98% серной кислотой. Низу 17 отводится приблизительно 100% серная кислота, которая используется для осушки. Контактный газ из абсорбера 17 после извлечения из него SO3 направляется на вторую ступень контактировпниию в реактор 15, на 4 и 5 слой катлизатора.
Контпктный газ подогревается в теплообменниках 20, 19, 18 до 400 градусов и поступает на 4 слой катализатора. После него газ охлаждается в теплообменнике 20 и поступает на 5 слой катализатора. После 5 слоя катализатора контактный газ охлаждается в теплообменнике 19 и поступает на абсорбцию в абсорбер 21, который работает аналогично абсорберу 17.
Обратный газ с содержанием оксидов серы менее 0,1% либо выбрасывается в атмлсферу, либо поступает на дальнейшую оистку на крупных установках. Оксиды серы или преращаются в смесь сульфитов или сульфатов или восстанавливаются до элементарной серы.
Данный способ производства серной кислоты ДК/ДА на сегодняшний день в техническом отношении является современным способом. Тем не менее у него имеются недостатки.
На стадии мокрой очистки приходится охлаждать и увлажнять, а для следующей стадии приходится осушать и подогревать.
В настоящее времяразработан новый способ получения серной кислоты - серная кислота особая.
Полученный печной газ после очистки в сухих электрофильтрах направляется в контактный аппарат со специальными катализаторами, который не боиться контактных ядов и паров влаги. Полученный контактный газ далее направляется на абсорбцию водой в паровой фазе. При этом сразу подучается серная кислоты в виде тумана, который осаждается на мощных электрофильтрах. Есть варианты этой системы, где используется стадия предварительного катализа для уничтожения контактных ядов.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕПУБЛИКИ БЕЛАРУСЬ
БЕЛОРУСКИЙ ГОСУДАРСТВЕННЫЙ ЭКОНОМИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра технологии
Индивидуальная работа на тему:
«Производство серной кислоты контактным способом».
Выполнил студент I курса ФБД: Клименок М. А.
Проверил преподаватель: Тарасевич В. А.
Минск 2002г.
· Реферат
· Описание контактного способа производства серной кислоты
· Принципиальная технологическая схема производства серной кислоты контактным способом
· Динамика трудозатрат при развитии технологического процесса
· Расчёт уровня технологии, тех вооруженности и производительности живого труда
· Заключение
· Литература и источники
Данная работа состоит из 12 страниц.
Ключевые слова: Серная кислота, Контактный способ, Реакция, Технология производства, Динамика трудозатрат, Технологический процесс.
В данной работе изучена и описана технология производства серной кислоты контактным способом. Приведены иллюстрации, схемы, графики, и таблицы, отражающие суть технологического процесса. Выделены важнейшие тенденции развития производства серной кислоты контактным способом
Проведён анализ динамики трудозатрат живого и прошлого труда а также динамика трудозатрат при развитии технологического процесса. Рассчитан уровень технологии, тех вооруженности и производительности живого труда. Сделаны соответствующие выводы и заключения.
Описание контактного способа производства серной кислоты
Контактным способом производится большое количество сортов серной кислоты, в том числе олеум, содержащий 20% свободной SO3, купоросное масло (92,5% Н 2 SO 4 и 7,5% Н 2 О), аккумуляторная кислота, примерно такой же концентрации, как и купоросное масло, но более чистая.
Контактный способ производства серной кислоты включает три стадии: очистку газа от вредных для катализатора примесей; контактное окисление сернистого ангидрида в серный; абсорбцию серного ангидрида серной кислотой. Главной стадией является контактное окисление SO 2 в SO 3 ; по названию этой операции именуется и весь способ.
Контактное окисление сернистого ангидрида является типичным примером гетерогенного окислительного экзотермического катализа. Это один из наиболее изученных каталитических синтезов.
Равновесие обратимой реакции
2SO 2 + O 2 >< 2 SO 3 + 2 x 96,7 кдж (500 оС) (а)
в соответствии с принципом Ле-Шателье сдвигается в сторону образования SO 3 при понижении температуры и повышении давления; соответственно увеличивается равновесная степень превращения SO 2 в SO 3
Следует отметить, что повышение давления естественно увеличивает и скорость реакции (а). Однако повышенное давление в этом процессе применять нерационально, так как кроме реагирующих газов пришлось бы сжимать балластный азот, составляющий обычно 80 % от всей смеси и поэтому в производственном цикле активно используют катализаторы.
Наиболее активным катализатором является платина, однако она вышла из употребления вследствие дороговизны и легкой отравляемости примесями обжигового газа, особенно мышьяком. Окись железа дешевая, но при обычном составе газа - 7% SO2 и 11% О2 она проявляет каталитическую активность только при температурах выше 625 оС, т.е. когда хр 70%, и поэтому применялась лишь для начального окисления SO2 до достижения хр 50-60%. Ванадиевый катализатор менее активен, чем платиновый, но дешевле и отравляется соединениями мышьяка в несколько тысяч раз меньше, чем платина; он оказался наиболее рациональным и только он применяется в производстве серной кислоты. Ванадиевая контактная масса содержит в среднем 7% V2O5; активаторами являются окислы щелочных металлов, обычно применяют активатор К2О; носителем служат пористые алюмосиликаты. В настоящий момент катализатор применятся в виде соединения SiO2, K  и/или Cs, V в различных пропорциях. Такое соединение оказалось наиболее устойчивым к кислоте и наиболее стабильным. Во всем мире его более корректное названия «ванадий - содержащий». Такой катализатор разработан специально для работы с невысокими температурами, что приводит в меньшим выбросам в атмосферу. Кроме того - такой катализ дешевле нежели калий/ванадиевый. Обычные ванадиевые контактные массы представляют собой пористые гранулы, таблетки или кольца (Рис. 1).
и/или Cs, V в различных пропорциях. Такое соединение оказалось наиболее устойчивым к кислоте и наиболее стабильным. Во всем мире его более корректное названия «ванадий - содержащий». Такой катализатор разработан специально для работы с невысокими температурами, что приводит в меньшим выбросам в атмосферу. Кроме того - такой катализ дешевле нежели калий/ванадиевый. Обычные ванадиевые контактные массы представляют собой пористые гранулы, таблетки или кольца (Рис. 1).
При условиях катализа окись калия превращается в K2S2O7, а контактная масса в общем представляет собой пористый носитель, поверхность и поры которого смочены пленкой раствора пятиокиси ванадия в жидком пиросульфате калия.
Ванадиевая контактная масса эксплуатируется при температурах от 400 до 600 оС. При увеличении температуры выше 600 оС начинается необратимое снижение активности катализатора вследствие спекания компонентов с образованием неактивных соединений, не растворимых в пиросульфате калия. При понижении температуры активность катализатора резко снижается вследствие превращения пятивалентного ванадия в четырехвалентный с образованием малоактивного ванадила VOSO4.
Процесс катализа слагается из стадий: 1) диффузии реагирующих компонентов из ядер газового потока к гранулам, а затем в порах контактной массы; 2) сорбции кислорода катализатором (передача электронов от катализатора к атомам кислорода); 3) сорбции молекул SO2 с образованием комплекса SO2 * О * катализатор; 4) перегруппировки электронов с образованием комплекса SO2 * катализатор; 5) десорбции SO3 из пор контактной массы и от поверхности зерен.
При крупных гранулах контактной массы суммарная скорость процесса определяется диффузией реагентов (1-я и 6-я стадии). Обычно стремятся получить гранулы не более 5 мм в поперечнике; при этом процесс идет на первых стадиях окисления в диффузионной, а на последних (при х 80%) в кинетической области.
Вследствие разрушения и слеживания гранул, загрязнения слоя, отравления катализатора соединениями мышьяка и температурной порчи его при случайных нарушениях режима ванадиевая контактная масса заменяется в среднем через 4 года. Если же нарушена очистка газа, получаемая обжигом колчедана, то работа контактного аппарата нарушается вследствие отравления первого слоя контактной массы через несколько суток. Для сохранения активности катализатора применяется тонкая очистка газа мокрым способом.
Принципиальная технологическая схема производства серной кислоты контактным способом
Лучшим сырьем для производства сернистого газа служит сера, которая выплавляется из природных пород, содержащих серу, а также получается как побочный продукт при производстве меди, при очистке газов и т.п. Сера плавится при температуре 113 градусов С, легко воспламеняется и сгорает в простых по устройству печах (Рис. 2). Получается газ высокой концентрации, с маленьким содержанием вредных примесей.
Сжигание серы происходит по реакции S + O 2 > SO 2 + 296 кДж Фактически сера перед горением плавится и испаряется (т. кип. ~444 о С) и сгорает в газовой фазе. Таким образом, сам процесс горения гомогенный.

Компрессор и камера сгорания
Недогоревшая сера
Воздух для горения и догорания серы
Жидкая сера
Сжатый воздух
Продукт – обжиговый газ
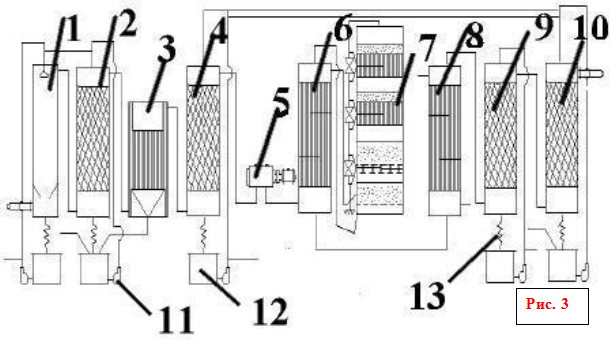
технологическая схема производства серной кислоты
1 - 1-я промывная башня; 2 - 2-я промывная башня с насадкой; 3 - мокрый электрофильтр; 4 - сушильная башня с насадкой; 5 - турбокомпресор; 6 - трубчатый теплообменник; 7 - контактный аппарат; 8 - трубчатый холодильник газа; 9 и 10 - абсорбционные башни с насадкой; 11 - центробежные насосы; 12 - сборники кислоты; 13 - холодильники кислоты
Обжиговый газ после грубой очистки от пыли в огарковых электрофильтрах при температуре около 300 оС поступает в полую промывную башню (Рис. 3: 1,2), где разбрызгивается холодная серная кислота (75%-ная H 2 SO 4). При охлаждении газа имеющиеся в нем серный ангидрид и пары воды конденсируются в виде мельчайших капелек. В этих капельках растворяется окись мышьяка. Образуется мышьяковокислотный туман, который частично улавливается в первой башне и во второй башне с керамиковой насадкой. Одновременно улавливаются остатки пыли, селен и другие примеси. Образуется грязная серная кислота (до 8% от общей выработки), которую выдают как нестандартную продукцию. Окончательная очистка газа от трудноуловимого мышьяковокислотного тумана производится в мокрых фильтрах (Рис. 3: 3), которые устанавливают последовательно (два или три). Принцип действия мокрых фильтров таков же, как и сухих. Капельки туммана осаждаются на трубчатых осадительных электродах, изготовленных из свинца или пластмассы «АТМ», и стекают вниз. Очистка газа завершается осушкой его от паров воды купоросным маслом в башне с насадкой (Рис. 3: 4). Обычно устанавливаются две сушильные башни. Башни, газоходы и сборники кислоты в отделении очистки обычно устанавливают стальные, футерованные кислотоупорным кирпичом или диабазовой плиткой. Сухой сернистый газ и серный ангидрид не агрессивны, поэтому всю последующую аппаратуру вплоть до моногидратного абсорбера можно монтировать из обычной углеродистой стали без защиты от коррозии.
Большое количество аппаратуры создает значительное сопротивление потоку газа (до 2 м вод.ст.), поэтому для транспортировки газа устанавливается турбокомпрессор (Рис. 3: 5). Компрессор, просасывая газ из печей через всю аппаратуру, нагнетает его в контактный узел.
Контактный узел (Рис. 3: 6,7,8) состоит из контактного аппарата, кожухотрубного теплообменника и не показанного на схеме (Рис. 4). огневого пускового подогревателя газа. В теплообменнике пускового подогревателя газ нагревается перед поступлением в аппарат при пуске или при падении температуры в аппарате ниже нормы.
Обычно применяются полочные контактные аппараты. Такой аппарат имеет цилиндрический корпус диаметром от 3 до 10 и высотой 10-20 м. Внутри корпуса установлены четыре-пять решеток со слоем гранул контактной массы на каждой из них. Между слоями контактной массы установлены промежуточные трубчатые или коробчатые теплообменники. На схеме представлен четырехслойный контактный аппарат, хотя чаще применяются пятислойные аппараты, но принцип их дествия полностью аналогичен, разница лишь в еще одном слое ктализатора. Свежий газ подогревается за счет тепла прореагировавшего горячего газа сначала во внешнем теплообменнике, потом он частично или полностью проходит для подогрева последовательно три-четыре внутренних теплообменника, при 440-450 о С поступает в первый слой контактной массы. Эта температура регулируется открыванием задвижек. Главное назначение внутренних теплообменников - охлаждение частично окисленного и разогретого в слое катализатора газа, таким образом, чтобы режим ступенчато приближался к кривой оптимальных температур.
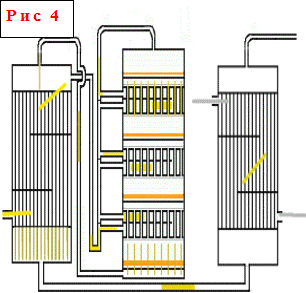 Полочные контактные аппараты - один из наиболее распространненых типов контактных аппаратов. Принцип их действия состоит в том, что подогрев и охлаждение газа между слоями катализатора, лежащими на полках, производится в самом контактном аппарате с использованием различных теплоносителей или способов охлаждения.В аппаратах такого типа высота каждого нижележащего слоя катализатора выше, чем расположенного над ним, т.е. увеличивается по ходу газа, а высота теплообменников уменьшается, так как по мере возрастания общей степени превращения скорость реакции снижается и соответственно уменьшается количество выделившегося тепла. В межтрубном пространстве теплообменников последовательно снизу вверх проходит свежий газ, охлаждая продукты реакции и нагреваясь до тепмпературы начала реакции
Полочные контактные аппараты - один из наиболее распространненых типов контактных аппаратов. Принцип их действия состоит в том, что подогрев и охлаждение газа между слоями катализатора, лежащими на полках, производится в самом контактном аппарате с использованием различных теплоносителей или способов охлаждения.В аппаратах такого типа высота каждого нижележащего слоя катализатора выше, чем расположенного над ним, т.е. увеличивается по ходу газа, а высота теплообменников уменьшается, так как по мере возрастания общей степени превращения скорость реакции снижается и соответственно уменьшается количество выделившегося тепла. В межтрубном пространстве теплообменников последовательно снизу вверх проходит свежий газ, охлаждая продукты реакции и нагреваясь до тепмпературы начала реакции
Производительность контактных аппаратов в пересчете на H 2 SO 4 в зависимости от их размеров составляет от 50 до 500 т в сутки H 2 SO 4 . Разработаны конструкции контактных аппаратов мощностью 1000 и 2000 т в сутки. В аппарат загружают 200-300 л контактной массы на 1 т суточной выработки. Трубчатые контактные аппараты применяются для окисления SO 2 реже, чем полочные. Для окисления сернистого газа повышенной концентрации рационально применять контактные аппараты с кипящими слоями катализатора.
Абсорбцию серного ангидрида по реакции SO 3 +H 2 O = H 2 SO 4 +9200 Дж обычно проводят в башнях с насадкой (Рис. 3: 9,10), так как барботажные или пенные абсорберы при большой интенсивности работы обладают повышенным гидравлическим сопротивлением. Если парциальное давление водяных паров над поглощающей кислотой значительно, то SO 3 соединяется с H 2 O в газовой фазе и образует мельчайшие капельки трудноуловимого сернокислотного тумана. Поэтому абсорбцию ведут концентрированными кислотами. Наилучшей по абсорбционной способности является кислота, содержащая 98,3% Н 2 SO 4 и обладающая ничтожно малой упругостью как водяного пара, так и SO 3 . Однако за один цикл в башне невозможно закрепление кислоты с 98,3% до стандартного олеума, содержащего 18,5-20% свободного серного ангидрида. Ввиду большого теплового эффекта абсорбции при адиабатическом процессе в башне кислота разогревается и абсорбция прекращается. Поэтому для получения олеума абсорбцию ведут в двух последовательно установленных башнях с насадкой: первая из них орошается олеумом, а вторая - 98,3%-ной серной кислотой. Для улучшения абсорбции охлаждают как газ, так и кислоту, поступающую в абсорбер, при этом увеличивается движущая сила процесса.
Во всех башнях контактного производства, включая и абсорберы, количество орошающей кислоты во много раз больше, чем нужно для поглощения компонентов газа (Н 2 О, SO 3) и определяется тепловым балансом. Для охлаждения циркулирующих кислот устанавливаются обычно оросительные холодильники, в трубах которых, орошаемых снаружи холодной водой, протекает охлаждаемая кислота.
Производство серной кислоты значительно упрощается при переработке газа, получаемого сжиганием предварительно расплавленной и профильтрованной природной серы, почти не содержащей мышьяка. В этом случае чистую серу сжигают в воздухе, который предварительно высушен серной кислотой в башне с насадкой. Получается газ 9% SO2 и 12% О2 при температуре 1000 оС, который сначала направляется под паровой котел, а затем без очистки в контактный аппарат. Интенсивность работы аппарата больше, чем на колчеданном газе, вследствие повышенной концентрации SO2 и О2. В аппарате нет теплообменников, так как температура газов снижается добавкой холодного воздуха между слоями. Абсорбция SO3 производится так же, как и в технологической схеме.
Важнейшие тенденции развития производства серной кислоты контактным способом:
1) интенсификация процессов проведением их во взвешенном слое, применением кислорода, производством и переработкой концентрированного газа, применением активных катализаторов;
2) упрощение способов очистки газа от пыли и контактных ядов (более короткая технологическая схема);
3) увеличение мощности аппаратуры;
4) комплексная автоматизация производства;
5) снижение расходных коэффициентов по сырью и использование в качестве сырья серосодержащих отходов различных производств;
6) обезвреживание отходящих газов.
Динамика трудозатрат при развитии технологического процесса
В общем виде весь вышеизложенный материал можно изобразить следующим образом:

Известно что данный технологический процесс и динамику трудозатрат харрактеризуют следующие формулы:
Тж = ---------------------- Тп = 0,004 * t 2 +0,3 Тс = Тж + Тп
Взаимосвязь между этими формулами выглядит так:
Тп = 0,004 * - 75 +0,3 и Тж = 21 * Тп-0,3 +1575
Основываясь на вышеизложенных формулах проведём расчёты и сведём их в общую таблицу (Таб. 1):
| (Таб. 1): Динамика трудозатрат на производстве серной кислоты на 15 лет |
|||||||||||||||
| t (Время, года) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| Затраты живого труда | 0,78 | 0,75 | 0,71 | 0,654 | 0,595 | 0,54 | 0,48 | 0,43 | 0,38 | 0,34 | 0,3 | 0,27 | 0,24 | 0,22 | 0,198 |
| Затраты прошлого труда | 0,3 | 0,32 | 0,34 | 0,364 | 0,4 | 0,44 | 0,496 | 0,56 | 0,62 | 0,7 | 0,78 | 0,88 | 0,98 | 1,08 | 1,2 |
| Совокупные затраты | 1,09 | 1,07 | 1,04 | 1,018 | 0,995 | 0,98 | 0,976 | 0,98 | 1,01 | 1,04 | 1,09 | 1,15 | 1,22 | 1,3 | 1,398 |
На основании таблицы построим графики зависимостей Тж, Тп, Тс от времени (Рис. 7) и зависимости Тж от Тп (Рис. 6) и Тп от Тж (Рис. 8).
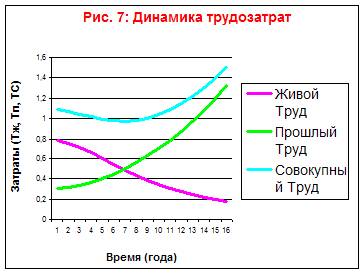
Из данного графика видно, что данный технологический процесс является ограниченным в своём развитии.
Экономический предел накопления прошлого труда наступит через семь лет.
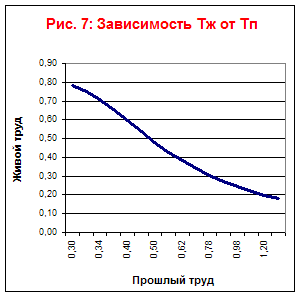
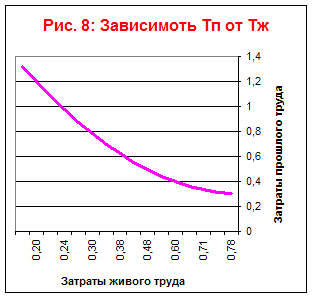
Из графиков 7 и 8 видно что вид технологического процесса является трудосберегающим.
Расчёт уровня технологии, тех вооруженности и производительности живого труда.
Уровень технологии рассчитывается по формуле:
Утех = 1/Тж * 1/ ТП
Производительность живого труда:
L = У тех * В
Техническая вооружённость рассчитывается:
В = Тп / Тж
Относительный уровень технологии:
Уотнос = Утех/ L
Проведём расчёты используя приведёные выше формулы и данные занесём в таблицу (Таб. 2):
| T Время (года) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| Затраты живого труда | 0,78 | 0,75 | 0,71 | 0,654 | 0,595 | 0,54 | 0,48 | 0,43 | 0,38 | 0,34 | 0,3 | 0,27 | 0,24 |
| Затраты прошлого труда | 0,3 | 0,32 | 0,34 | 0,364 | 0,4 | 0,44 | 0,496 | 0,56 | 0,62 | 0,7 | 0,78 | 0,88 | 0,98 |
| Совокупные затраты | 1,09 | 1,07 | 1,04 | 1,018 | 0,995 | 0,98 | 0,976 | 0,98 | 1,01 | 1,04 | 1,09 | 1,15 | 1,22 |
| Уровень технологии | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 | 4,2 |
| Тех. вооруженность | 0,39 | 0,42 | 0,47 | 0,556 | 0,672 | 0,83 | 1,033 | 1,3 | 1,64 | 2,058 | 2,58 | 3,22 | 4 |
| Производительность Тж | 1,28 | 1,33 | 1,41 | 1,529 | 1,68 | 1,86 | 2,083 | 2,34 | 2,62 | 2,94 | 3,29 | 3,68 | 4,1 |
| Относ уровень технологии | 3,29 | 3,16 | 2,98 | 2,747 | 2,5 | 2,25 | 2,016 | 1,8 | 1,6 | 1,429 | 1,28 | 1,14 | 1,02 |
Из данной таблицы видно что рационалистическое развитие целесообразно только в течении семи лет поскольку в этот период времени относительный уровень технологии больше производительности живого труда.
Заключение
В данной работе изучена и описана технология производства серной кислоты контактным способом, проведён анализ динамики трудозатрат живого и прошлого труда а также динамика трудозатрат при развитии технологического процесса. На основании проделанной работы получены следующие выводы: Развитие тех процесса ограничено, экономический предел накопления прошлого труда равен семи годам, данный технологический процесс является трудосберегающим и рационалистическое развитие целесообразно в течении семи лет.
Литература и источники:
1. ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ /Бараненко Д. http://service.sch239.spb.ru:8101/infoteka/root/chemistry/room1/baran/chem.htm
2. Технология важнейших отраслей промышленности: Учеб. Для эк. Спец. Вузов / А.М. Гинберг, Б.А. Хохлов. – М.: Высшая школа, 1985.

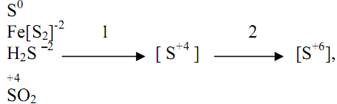
Стадии – подготовка сырья и его сжигание или обжиг. Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени, определяет сложность технологического производства серной кислоты. 1. Железный колчедан. Природный железный колчедан представляет сложную породу, состоящую из сульфида железа РеБ2, сульфидов других металлов (меди, цинка, свинца и др.), ...
Еще не всегда осуществима. В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих...
![]()
Для автоматического регулирования необходимо максимально знать требования, предъявляемые различным химико-технологическим процессом. 1.Основная часть 1.1 Технологический процесс получение серного ангидрида при получении серной кислоты. Производство серной кислоты контактным способом состоит из следующих действий: 1. Разгрузка, складирование и подготовка сырья...
Образуется азотная кислота: NO(HSO4) + H2O®H2SO4 + HNO2 Она - то и окисляет SO2 по уравнению: SO2 + 2HNO2®H2SO4 + 2NO В нижней части башен 1 и 2 накапливается 75% - ная серная кислота, естественно, в большем количестве, чем её было затрачено на приготовление нитрозы (ведь добавляется «новорождённая» серная кислота). Окись азота NO возвращается снова на окисление. Поскольку некоторое количество...
Еще в 13 веке серную кислоту получали из железного купороса FeSO 4 , откуда и название одного из сортов серной кислоты – купоросное масло.
С 18 века серную кислоту получали нитрозным методом, который лишь в середине ХХ века был вытеснен контактным способом.
Первая стадия сернокислотного производства – получение сернистого газа из серосодержащего сырья. В качестве сырья могут быть использованы элементарная сера, серный колчедан (пирит), сероводород Н 2 S и т. д. После очистки диоксид серы окисляют до трехоксида в присутствии катализатора.
В нитрозном методе катализатором служили оксиды азота. Диоксид серы окисляют в основном в жидкой фазе в башнях (колоннах) с насадкой. Поэтому этот метод называют иначе башенным. Нитрозный метод обладает рядом недостатков, главным из которых является загрязнение атмосферы такими вредными газами, как NO 2 , SO 2 и SO 3 . Кроме того, получаемая серная кислота имеет низкую концентрацию и загрязнена побочными продуктами. В контактном же способе применяют твердые катализаторы и получают более концентрированную кислоту и без примесей побочных продуктов.
Сырье процесса. Кроме упомянутых выше серного колчедана, элементарной серы, сероводорода, источниками сырья для производства серной кислоты могут служить сульфиды металлов: медный колчедан CuFeS 2 , медный блеск CuS 2 , сульфаты: гипс CaSO 4 2H 2 O, ангидрит CaSO 4 , мирабилит Na 2 SO 4 10H 2 O и т.д.
На территории России залежей самородной серы нет. Получение газовой серы из сероводорода, извлекаемого при очистке горючих и технологических газов, основано на процессе неполного окисления на твердом катализаторе. При этом протекают реакции:
H 2 S + 1,5 O 2 = SO 2 + H 2 O;
H 2 S + SO 2 = 2H 2 O + 1,5 S 2 .
Значительные количества серы могут быть получены из продуктов производства цветных металлов, например меди:
2FeS 2 = FeS +S 2 ;
SO 2 + C = S + CO 2 ;
CS 2 + SO 2 = 1,5S 2 + CO 2 ;
2COS + SO 2 = 1,5S 2 + 2CO 2 .
Обжиг серного колчедана. Это гетерогенный высокотемпературный (до 1000 о С ), необратимый каталитический процесс, включающий ряд стадий. Основная реакция протекает по схеме
4FeS 2 +11O 2 = 2Fe 2 O 3 + 8SO 2 + 3420 кДж/ моль .
При недостатке кислорода протекает иная реакция
3FeS 2 + 8O 2 = Fe 3 O 4 + 6SO 2 + 2440 кДж/ моль .
При окислении сульфида железа на поверхности зерна минерала получается слой оксидов, толщина которого растет по мере выгорания серы из минерала. Общая скорость процесса при этом определяется скоростью диффузии газов в порах этого слоя оксидов. Следовательно, процесс обжига колчедана протекает во внутридиффузионной области. Скорость процесса в целом описывается уравнением
= kF . (9.1)
Из уравнения следует, что скорость процесса можно увеличить путем повышения коэффициента массопередачи k , для чего эффективнее всего поднимать температуру. Но при 850–1000 о С материал в печи спекается и резко снижается реакционная поверхность F .
Поэтому температура процесса определяется химическим составом и природой колчедана, а также конструкцией печи.
Для увеличения движущей силы процесса С повышают концентрацию пирита в колчедане и кислорода в зоне обжига. Концентрацию пирита повышают путем флотации руды, а кислорода – применением избытка воздуха, в 1,5–2 раза превышающего стехиометрическое.
Для повышения поверхности соприкосновения фаз флотационный колчедан измельчают до размеров частиц 0,3–0,03 мм .
Совершенствование технологии обжига колчедана шло от применения механических полочных печей к печам пылевидного обжига и далее к современным печам с кипящим слоем колчедана, которые практически вытеснили все остальные типы печей.
Печь представляет собой цилиндрическо- коническую камеру, в нижней части которой установлен газораспределительная решетка, на которую непрерывно поступает обжиговый материал. Под решетку подается воздух со скоростью, обеспечивающей переход частиц во взвешенное состояние, но недостаточную для выноса частиц материала из печи. Производительность таких печей в 10 раз выше, чем любых других и составляет 1800 кг/м 3 реакционного объема в сутки. При этом получают газ, содержащий до 14 % SO 2 . Теплоту реакции используют для выработки пара путем помещения в зону реакции теплообменных элементов, в которые подают воду, а получают пар. Производительность по пару составляет 1,3 т/т колчедана.
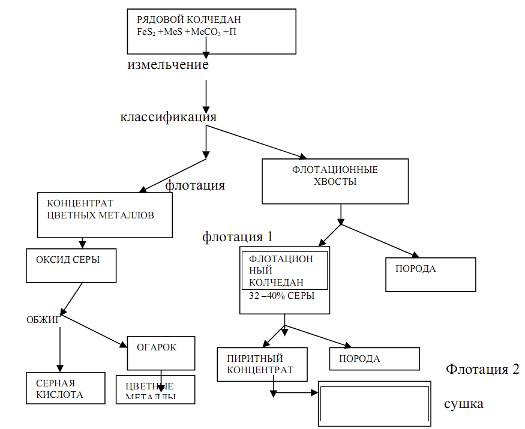
По технологическому оформлению производство серной кислоты из железного колчедана является очень сложным и включает ряд блоков, где последовательно проводят необходимые стадии процесса.
Структурная схема такого производства приведена ниже (рис. 9.4).
 пирит вода абсорбент 1 2 3 4 5 6 7
пирит вода абсорбент 1 2 3 4 5 6 7
пар хвостовые
воздух Н 2 SO 4 газы
Рис. 9.4. Структурная схема производства серной кислоты из колчедана: I – блок получения
обжигового газа; II – блок контактирования; III – блок абсорбции
Контактный способ производства серной кислоты. Этот способ после получения диоксида серы включает еще 3 стадии:
1) очистку газа от вредных для катализатора примесей;
2) контактное окисление SO 2 в SO 3 ;
3) абсорбцию SO 3 серной кислотой.
Очистка газа. От огарковой пыли газ очищают сначала в циклонах, а затем, после использования теплоты газа, - в сухих электрофильтрах. После печей кипящего слоя доля пыли в газах составляет 200 г/см 3 , после циклона – 20 г/см 3 , после фильтров – 0,1 г/см 3 .
Для полного освобождения газа от остатков пыли и более полного отделения от оксидов мышьяка и селена, являющихся каталитическими ядами, необратимо отравляющих катализатор, очистку ведут в промывных башнях серной кислотой концентрацией 93 – 95 %, а затем турбокомпрессором подают в контактное отделение для окисления диоксида серы.
Контактное окисление диоксида серы. Это основная стадия процесса производства серной кислоты. Является типичным примером гетерогенного экзотермического каталитического процесса.
2SO 2 +O 2 = 2SO 2 + 189 кДж / моль (при 500 0 С).
Согласно принципу Ле-Шателье, равновесие в этой реакции должно сдвигаться вправо при повышении давления и снижении температуры. На практике давление не повышают из-за небольших концентраций диоксида серы и кислорода в обжиговом газе (80 % азота).
Рост энергетических затрат при повышении давления превышает выгоду от этого приема. Константа равновесия в этой реакции равна
где P SO , P SO , P O - парциальные равновесные давления диоксида серы, триоксида серы и
кислорода соответственно.
Равновесная степень превращения SO 2 в SO 3
X р = (9.4)
или после преобразований
X P = (9.5)
или через концентрации
Х Р =  . (9.6)
. (9.6)
Зависимость равновесной степени превращения от состава газов при давлении 0,1 МПа
и
475 о С
следующая:
Таблица 9.2
Влияние параметров процесса на степень превращения SO 2 в SO 3
Как следует из табл. 9.2, степень превращения SO
2 в SO
3 находится в обратной зависимости от его концентрации. Но при низких концентрациях диоксида серы мала производительность процесса. Поэтому оптимальным считается газ, доля SO
2 в котором составляет 7–9 %, О
2 –
10–11 %.
Зависимость выхода SO 3 от температуры процесса при С SO = 7 %; C O = 11 % представлена на графике (рис. 9.5):
 | |||||
400 500 600 700 800 900 1000
Температура, о С
Рис. 9.5. Зависимость выхода SO 3 от температуры процесса
Как видно из графика, наибольший выход SO 3 (99,2 %) достигается при 400 о С . Однако при низких температурах мала скорость процесса и, следовательно, производительность процесса. Поэтому при работе на современных ванадиевых катализаторах окисление проводят в несколько стадий с постепенным снижением температуры от 580-600 о С - на первой стадии и до 400–450 о С - на последней.
Скорость процесса окисления SO 2 определяется в первую очередь активностью катализатора, а также параметрами процесса.
История развития процесса каталитического окисления SO 2 в SO 3 знает применение трех катализаторов: металлической платины, оксида железа (3) и оксида ванадия (5). Наиболее активна платина, но она дорога и подвержена необратимым отравлениям даже следами мышьяка и селена. Fe 2 O 3 , не подвержен отравлению мышьяком и селеном, но активен при высоких температурах (выше 625 о С), т.е. тогда, когда равновесная степень превращения равна менее 70 % и поэтому применяется лишь для предварительного контактирования до Х = 50–60 %.
Ванадиевые катализаторы с содержанием V 2 O 5 до 7 % - наиболее оптимальные. Они включают в качестве промоторов оксиды щелочных металлов, чаще всего К 2 О . Катализатор наносят на высокопористые носители – алюмосиликаты. Гранулы катализатора имеют размер не более 1,5 мм и хорошо противостоят диффузионному торможению внутри пор катализатора. Однако мелкие гранулы создают большое гидравлическое сопротивление и поэтому применяют зерна размером 5 мм .
На любом катализаторе степень превращения SO 2 возрастает во времени, приближаясь к равновесной по затухающей кривой. Чем выше температура, тем быстрее достигается состояние равновесия и тем ниже равновесный выход. Кинетическое уравнение процесса окисления SO 2 в SO 3 выведено Г.К. Боресковым и описывается следующим образом:
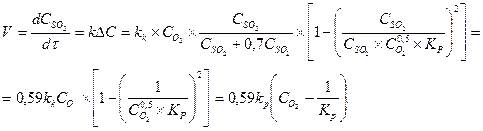
Как видно из данного уравнения, наибольшее влияние на изменение концентрации оказывает концентрация кислорода.
На рис. 9.6 представлена зависимость степени окисления SO 2 от времени контакта на ванадиевом катализаторе при различных температурах и давлении 0,1 МПа .
 | 475 о | ||||
  | |||||
| 600 о | |||||
| 425 о | |||||
0 0,5 1,0 1,5 2,0 2,5 3, 0
Рис. 9.6. Влияние температуры и времени контакта на степень окисления SO 2 в SO 3
(С SO = 7 %, C SO = 11 %, C N = 82 %)
Как показано в выше приведенных исследованиях, лимитирующей стадией катализа является сорбция О 2 . Повышение концентрации кислорода увеличивает скорость процесса и возможную степень окисления. Но повышая концентрацию кислорода, мы неизбежно снижаем концентрацию SO 2 , что приводит к снижению производительности процесса. Кроме того, в силу того, что данная реакция экзотермична, повышение температуры сдвигает равновесие в сторону меньшего значения С и общей скорости процесса. С другой стороны, константа скорости реакции с повышением температуры повышается, согласно закону Аррениуса.
На основании изложенного можно заключить, что для достижения максимальной скорости процесса следует начинать его при более высоких температурах (600 о С ), а затем снижать по кривой до 400 о С .
В реальных процессах подобная технология осуществляется в многополочных контактных аппаратах (см. рис. 9.7).
 |
|||||
2мм
вместо 4–5 мм
в аппаратах с фильтрующим слоем. В отличие от процесса со стационарным слоем катализатора, процесс с кипящим слоем катализатора протекает в кинетической области и обладает большей производительностью.
В современных технологиях степень окисления SO
2 в SO
3 достигает 99 %.
Абсорбция оксида серы (6). Процесс описывается следующей реакцией:
SO 3 + H 2 O = H 2 SO 4 + 92 кДж / моль
При этом наличие в газовой фазе даже незначительных количеств воды приводит к образованию мельчайших капель серной кислоты, которые образуют стойкий туман, плохо поглощаемый водой, кислотой и даже щелочью. Поэтому в газовой фазе, поступающей на абсорбцию, должны отсутствовать пары воды. Кроме того, парциальное давление паров воды над поглощающей жидкостью должно быть минимальным. Такому требованию наилучшим образом соответствует серная кислота, содержащая 98,3 % H 2 SO 4 , как следует из диаграммы кипения системы Н 2 О –SО 3 при атмосферном давлении. Такая кислота отличается ничтожным парциальным давлением как Н 2 О , так и SO 3 . Такая кислота практически полностью поглощает SO 3 . При этом кислоту подают в таком избытке, чтобы ее концентрация за один цикл повышалась на 0,2 %. С кислотой отводится и теплота абсорбции.
После охлаждения лишь небольшая часть кислоты отбирается в виде готовой продукции, а основная часть после добавки воды или разбавленной кислоты возвращается на абсорбцию.
На рис. 9.8. представлена зависимость скорости абсорбции от концентрации кислоты.
0 98,3 % Н 2 SO 4
Рис. 9.8. Зависимость скорости абсорбции
от концентрации серной кислоты
Схема двухстадийного процесса абсорбции представлена на рис. 9.9.
 SO 3 5 выходящие моногидрат
SO 3 5 выходящие моногидрат
олеум на склад
Рис. 9.9. Схема двухстадийного процесса абсорбции SO 3: 1 – холодильник газа; 2 – олеумный абсорбер; 3 - моногидратный аппарат; 4 – сушильный барабан; 5 – холодильники жидкого
продукта; 6, 7 – сборники олеума и моногидрата
На представленной схеме на первой стадии абсорбции SO 3 и абсорбент (20 % олеум) охлаждают до 80 о С перед абсорбцией. На второй стадии в качестве сорбента используют моногидрат.
Полная технологическая схема производства серной кислоты контактным способом называют ДК – ДА (двойное контактирование – двойная абсорбция) является гораздо более сложной и включает следующие отделения:
1) печное с сухой очисткой газа;
2) промывное, в котором газ подвергают мокрой очистке от остатков пыли, сернокислотного тумана, контактных ядов и водяных паров;
3) компрессорное;
4) контактное;
5) абсорбционное.
Производительность такой установки составляет до 1500 т / сутки по моногидрату. Расходные коэффициенты на 1 т моногидрата таковы: колчедан – 0, 82 т , вода – 50 м 3 , электроэнергия – 82 кВт ч.
Возможно, будет полезно почитать:
- Патриарх кирилл запретил актеру и священнику ивану охлобыстину служить в церкви Охлобыстин церковный сан ;
- Иван охлобыстин - биография, информация, личная жизнь Почему охлобыстин ушел из священников ;
- Ужин для ребенка 4 лет рецепты меню ;
- Принципы функционирования бюджетной системы РФ ;
- Особенности размещения населения на территории земли Население земли размещается равномерно средняя плотность населения ;
- Тонька-пулеметчица — cтрашная судьба страшного человека Фильм палач тонька пулеметчица реальная история ;
- Как поздравить начальницу с юбилеем? ;
- Российские студенты выиграли чемпионат мира по программированию Вот они, герои ;