Твердая сера. Сера это
Размещение электронов на орбиталях внешнего слоя
Валентных электронов у атома серы 6. Поэтому, ceра может образовывать до 6 валентных связей. Атом серы имеет больший радиус и потому проявляет меньшую электроотрицательность по сравнению скислородом. Степени окисления, которые может проявлять в окислитель-но-восстановительных реакциях: S 0 , S -2 , S +4 , S +6 .
■ 68. Напишите уравнения реакций серы с простыми веществами, о которых говорится в прочитанном отрывке, Являются ли эти реакции окислительно — восстановительными? Дайте обоснованный ответ.
69. Какова степень окисления серы в соединениях с водородом и металлами?
70. Какого типа в соединениях серы с металлами?.
71. Почему цинка и алюминия нельзя получить реакцией обмена в растворах?
72. Сколько сульфида железа (II) получится, если взято 30 г железа и 16 г серы и если взятое используется лишь на 90%?
Возможны и другие реакций, в результате которых сера приобретает положительные степени окисления. Обычно это бывает при непосредственном взаимодействии серы с кислородом - при горении серы:
S + О2 = SO2
Поскольку у кислорода величина электроотрицательности больше, чем у серы, в соединении SО2 сера проявляет степень окисления +4 и в данной реакции ведет себя как восстановитель. Более глубокое окисление воды до степени окисления +6 возможно при образовании серного ангидрида. В присутствии катализатора при температуре 400-500° двуокись серы окисляется кислородом, образуя серный ангидрид:
2SО2 + О2=2SО3
Несмотря на высокую химическую активность, сера довольно широко встречается в виде минерала, который называется самородной серой. Это почти исключительно ромбическая сера. Прочие аллотропные видоизменения серы в природе не встречаются.
Сера обычно вкраплена в различные горные породы, из которых довольно легко может быть выплавлена. чаще всего имеет вулканическое происхождение. Богаты Самородной серой Кавказ, пустыня Кара-Кум, Керченский полуостров, Узбекистан.
Сера встречается также в виде сернистых металлов «г-сульфидов ( FeS2, цинковая обманка ZnS, свинцовый блеск PbS), в виде сульфатов (глауберова соль Na2SO4 · 10H2O, CaSО4·2H2О). Сера входит в состав некоторых белков. Для того чтобы извлечь серу из породы, ее выплавляют в автоклавах Действием перегретого водяного пара при 150-160°. Полученную расплавленную серу рафинируют (очищают) возгонкой. Если ее расплавить и разлить по деревянным формочкам, то она затвердевает в виде палочек. Такую серу называют черенковой.

Рис. 52. Применение серы
Иногда серу выливают в большую форму, а после затвердевания раскалывают на мелкие бесформенные куски. Такая сера называется комовой. Наконец, серу можно получить в виде мелкого распыленного порошка - так называемого серного цвета.
Свободная сера применяется главным образом в производстве серной кислоты, а также в бумажной промышленности, для вулканизации каучука, в производстве красителей, в сельском хозяйстве для опыления и окуривания винограда и хлопчатника, в производстве спичек (рис. 52). В медицине сера используется в виде мазей вместе с другими веществами против чесотки и других кожных заболеваний. Чистая сера не ядовита.
■ 73. Перечислите химические свойства серы я укажите, в чём сходство и в чем различие серы и кислорода.
57. Соединения двухвалентной серы
Двухвалентная сера образует соединения с водородом ( H2S) и металлами ( Na2S, FeS). Сульфиды можно рассматривать как производные сероводорода, т. е. соли сероводородной кислоты.
Сероводород
. Молекула сероводорода построена по полярному типу связи:
Общие электронные пары сильно смещены в сторону атома, серы как более электроотрицательного.
Сероводород-газ тяжелее воздуха, с резким неприятным запахом тухлых яиц. Этот газ очень ядовит. Наши органы обоняния весьма чувствительны к сероводороду. При наличии 1/2000 части сероводорода в воздухе может наступить потеря обоняния. Хроническое отравление сероводородом в малых дозах вызывает исхудание, головные, боли. В случае более сильных отравлений через некоторое время может наступить обморок, а очень сильные концентрации вызывают смерть от паралича дыхания. При отравлениях сероводородом необходимо вынести рольного на свежий воздух и дать ему вдыхать небольшие количества хлора, а также чистый . Предельно допустимая концентрация сероводорода в рабочем помещении 0,01 мг/л.
Сероводород переходит в жидкое состояние при температуре -60°. Он хорошо растворяется в воде, образуя при этом сероводородную воду H2Saq или, как ее еще называют, сероводородную кислоту.
Сероводород - один из лучших восстановителей. Он легко восстанавливает бромную и хлорную воду вбромисто водородную или соляную кислоту:

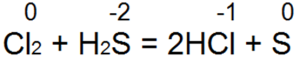
При этой реакции S(-2) окисляется до» нейтральной серы S(0).
Сероводород горит. При достаточном доступе воздуха (рис. 53,а) происходит полное сгорание по уравнению:
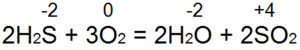
В этом случае S(-2) окисляется до S(+4), происходит отдача 6 электронов), а восстанавливается с О(0) до О(-2). Если
доступ воздуха недостаточный или если в пламя сероводорода внести холодный предмет (рис. 53,6), то происходит неполное сгорание по уравнению:
2H2S + О2 = 2S + 2H2O
■ 74. Назовите меры первой помощи при отравлениях сероводородом.
75. Почему сероводородную кислоту часто называют
сероводородной водой?
76. При смешивании йодной воды с сероводородной происходит обесцвечивание и помутнение раствора. Чем это объяснить?
77. Возможно ли для S(-2) проявление окислительных свойств?
В лаборатории сероводород получают в аппарате Киппа при взаимодействии сульфида железа (или сульфида натрия) с разбавленной серной кислотой:
FeS + H2SO4 = FeSО4 + H2S
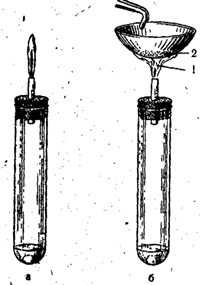
Рис. 53. Горение сероводорода при полном доступе воздуха (а) и при неполном доступе воздуха (б).
Сероводород, растворяясь в воде, образует слабую сероводородную кислоту, диссоциирующую двухступенчато:
H2S ⇄ Н + + HS — ⇄ 2Н + + S 2-
Вторая ступень протекает в незначительной степени.
Сероводородная кислота не может храниться в лаборатории длительное время вследствие своей неустойчивости. Она постепенно мутнеет в результате выделения свободной серы:
H2S = H2 + S
В окислительно-восстановительных реакциях сероводородная кислота Ведет себя как типичный восстановитель, например:
H2S + К2Cr2O7 + H2SO4 → (S 0 ; Cr +3)
Уравнение этой окислительно-восстановительной реакции закончите самостоятельно.
Сероводород применяется в аналитической химии.
Сероводородная кислота проявляет общие свойства кислот. Правда, не все свойства кислот удается наблюдать на ней. Например, такие , как , с ней не реагируют, а и , попадая в сероводородную, кислоту, реагируют не с ней, а с имеющейся там водой, образуя щелочь, которая затем может вступить в реакцию с сероводородной кислотой. Так как это кислота двухосновная, она может образовывать два ряда солей - сульфиды и гидросульфиды, или бисульфиды.
Средние соли сероводородной кислоты - сульфиды - нерастворимы в воде, кроме солей натрия и калия, и имеют различную окраску: сульфид свинца и железа - черную, цинка - белую, кадмия - желтую. Гидросульфиды хорошо растворимы в воде.
Реактивом на ион двухвалентной серы S 2- является ион кадмия Cd 2+ , который в соединении с ионом дает желтый, нерастворимый в воде осадок, например:
Cd(NO3)2 + H2S = CdS↓ + 2HNO3
Cd 2+ + S 2- = CdS
Сульфиды довольно легко гидролизуются по типу солей слабых кислот, поэтому обычно их получают прямым взаимодействием серы с металлом.
■ 78. Напишите уравнение реакции сероводородной кислоты с едким натром и объясните результат реакции, учитывая гидролиз соли в растворе.
79. В санитарно-гигиенических исследованиях для обнаружения В воздухе сероводорода пользуются очень чувствительной реакцией с растворимыми солями свинца. Что можно наблюдать при этой реакции в полной ионной и сокращенной ионной формах?
§ 58. Соединения четырехвалентной серы
Соединение четырехвалентной серы - двуокись серы (сернистый газ) SО2. Двуокись серы тяжелее воздуха и имеет резкий неприятный запах. Молекула двуокиси серы построена также по ковалентному типу связи, полярность ее слабо выражена. При -10° и атмосферном давлении двуокись серы превращается в жидкость, а затвердевает при -73°. Она хорошо растворима в воде (на 1 объем воды 40 объемов двуокиси серы), при этом наряду с растворением происходит взаимодействие с водой по уравнению:
SO2 + Н2О H2SО3
Получающаяся сернистая кислота является весьма непрочной, поэтому реакция обратима.
Двуокись серы имеет большое промышленное значение. Ее получают обжигом серного колчедана FeS2 или серы:
4FeS2 + 11О2 = 2Fe2О3 + 8SО2 S + О2 = SО2
В лаборатории ее получают действием сильных кислот на соли сернистой кислоты, например действием серной кислоты на :
Na2SO3 + H2SO4 = Na2SО4 + Н2О + SO2
Двуокись серы можно получить разложением солей сернистой кислоты, например сульфита кальция CaSО3, при нагревании;
CaSО3 = СаО + SO2
Двуокись серы ядовита. При отравлениях ею появляются хрипота, одышка, иногда потеря сознания. Допустимая концентрация SО2 в воздухе равна 0,02 мг/л.
При взаимодействии с органическими красителями двуокись серы может вызвать их обесцвечивание, однако причина этого иная, чем при обесцвечивании хлором: не происходит окисления, а возникает бесцветное соединение SО2 с красителем, которое с течением времени разрушается и окраска красителя восстанавливается.
■ 80. Предложите чертежи приборов, с помощью которых можно получить двуокись серы: а) из сульфита натрия действием кислоты: б) прокаливанием сульфита кальция.
81. Двуокись серы, полученную при разложении 40 г сульфита кальция, пропустили через 500 г раствора баритовой воды Ва(ОН)2, в результате чего весь , находившийся в растворе, был осажден. Какова процентная баритовой воды, если 20% двуокиси серы, полученной при обжиге, теряется?
82. К какой группе окислов относится двуокись серы? Перечислите ее свойства, типичные для этой группы окислов. Подтвердите свой ответ уравнениями реакций.
83. Почему при пропускании SО2 через известковую воду возникает помутнение, как и при пропускании СО2?
84. Воздух имеет примесь двуокиси серы. Как освободить его от этой примеси?
85. Какой объем двуокиси серы может быть получен из 20 молей FeS2 при 80% выходе?
86. Через 200 мл 20% раствора едкого натра была пропущена двуокись серы до полного превращения едкого натра в сульфит (гидролиз не учитывать). Какова концентрация образовавшегося раствора сульфита натрия?
В связи с тем что степень окисления серы в двуокиси серы равна + 4, т. е. условно с внешнего уровня атома серы отдано 4 электрона, для него существуют две возможности: либо он может дополнительно отдать оставшиеся на внешнем слое 2 электрона и тогда проявит
свойства восстановителя, либо S(+4) может принять некоторое количество электронов и тогда будет проявлять окислительные свойства.
Например, в присутствии сильного окислителя S (+4) ведет себя как восстановитель.
Вr2 + Н2О + SO2 → H2SO4 + НВr
КМnO4 + Н2O + SO2 → K2SO4 + MnSO4 + H2SO4
K2Cr2O7 + SO2 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
Коэффициенты этих реакций найдите самостоятельно.
Особое значение имеет окисление двуокиси серы кислородом в присутствии катализатора V2O5 или Pt при температуре 400-500°, в результате чего образуется серный ангидрид:
2SO2 + О2 = 2SO3
Этот процесс широко используется в производстве серной кислоты контактным способом.
В присутствии сильных восстановителей, например сероводорода, S (+4)ведет себя как окислитель: H2SO3+ H2S → Н2O + S
Найдите, составив электронный баланс, коэффициенты для данного уравнения.
■ 87. Запишите в тетрадь физические и химические свойства двуокиси серы, отметив как реакции, протекающие без изменения степеней окисления, так и окислительно-восстановительные.
88. Каково физиологическое действие двуокиси серы?
Как было уже сказано, при растворении двуокиси серы в воде образуется сернистая кислота.
Сернистая кислота - кислота средней силы. Она диссоциирует двухступенчато:
H2SO3 ⇄ 2 Н + + HSO 3 — ⇄ 2Н+ + SO 2 3 —
Сернистая кислота нестойкая, быстро разлагается на двуокись серы и воду:
H2SO3 ⇄ H2O + SO2
Поэтому провести, например, реакцию с металлами более активными, чем , с сернистой кислотой нельзя.
Будучи двухосновной, сернистая кислота может образовывать два ряда солей: средние - сульфиты и кислые - гидросульфиты. Все сульфиты являются нерастворимыми солями, за исключением сульфитов щелочных металлов и аммония. У гидросульфитов несколько выше. Эти соли могут разлагаться под действием более сильных кислот:
Na2SOs + H2S04 = Na2SО4 + Н2О + SO2
2NaHSО3 + H2SO = Na2SО4 + 2H2О + 2SO2
При действии кислот на сульфиты выделяется двуокись серы, обладающая неприятным запахом. Этой реакцией пользуются для того, чтобы отличить соли сернистой кислоты от карбонатов, которые ведут себя аналогично, но двуокись углерода запаха не имеет.
Сульфиты довольно легко подвергаются гидролизу.
§ 59. Соединения шестивалентной серы
Как уже упоминалось, при окислении двуокиси серы образуется серный ангидрид SО3- соединение шестивалентной серы. При образовании молекулы серного ангидрида в образовании валентных связей участвуют все валентные электроны серы, как s
-,так и р
-орбиталей. Степень окисления +6 для, серы является максимальной положительной. Поэтому S +6 никогда не может вести себя как восстановитель.
Серный ангидрид - белое кристаллическое вещество. Температура плавления его 17°, температура кипения 45°. Серный ангидрид настолько гигроскопичен, что хранить его в обычной посуде нельзя. Его хранят в запаянных стеклянных ампулах.
Серный ангидрид - кислотный окисел, обладающий всеми типичными свойствами этой группы веществ. В частности, он может реагировать с водой, образуя серную кислоту:
SО3 + Н2О = H2SО4
■ 89. Напишите самостоятельно уравнения реакций серного ангидрида с основаниями и с основными окислами.
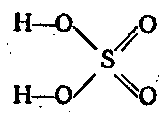
Серный ангидрид является сильным окислителем. Наиболее важным соединением шестивалентной серы является H2SО4. Она принадлежит к числу сильных кислот. двухосновная и диссоциирует двухступенчато:
H2SО4 ⇄ Н + + HSО 4 — ⇄ 2Н + + SO 2 4 —
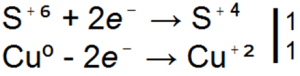
Концентрированная серная кислота реагирует с металлами, более активными, чем водород, иначе, чем разбавленная. например, из концентрированной серной кислоты не вытесняет водород, а восстанавливает серную кислоту до двуокиси серы, свободной серы или сероводорода:
H2SО4 + Zn → ZnSО4 + SO2
H2SО4 + Zn → ZnSО4 + S
H2SО4 + Zn → ZnSО4 + H2S
■ 91. Все три приведенных уравнения реакций серной кислоты с цинком являются окислительно-восстановительными. Расставьте в них коэффициенты на основе электронного баланса.
Безводная серная кислота называется моногидратом. Моногидрат не содержит ионов и поэтому не проводит электрического тока. Моногидрат хорошо поглощает влагу. Поскольку многие реакции серной кислоты с металлами являются ионными, моногидрат не вступает в реакцию с некоторыми металлами, более активными, чем водород, например с железом, поэтому его можно перевозить в железных цистернах. , устойчивы к серной кислоте в любых концентрациях. Концентрированная серная кислота окисляет и некоторые неметаллы, например .
■ 93. В чем сходство И различие серной кислоты с другими кислотами?
94. Могут ли осуществляться реакции, в которых серная кислота проявляла бы восстановительные свойства?
95. Как осуществить следующие превращения:

Напишите уравнения соответствующих реакций. Для окислительно-восстановительных составьте электронный баланс, уравнения ионных реакций напишите в ионной форме.
96. В одной склянке находится раствор серной кислоты, в другой - азотной, в третьей - соляной. Как их различить?
21
Сера
СЕ́РА -ы; ж.
1. Химический элемент (S); легко воспламеняющееся вещество жёлтого цвета (применяется в промышленности, военном деле, сельском хозяйстве, медицине).
2. Жёлтое жирное вещество, образующееся на стенках ушного канала. Прочистить от серы уши.
◁ Се́рный (см.).
се́ра(лат. Sulfur), химический элемент VI группы периодической системы. Жёлтые кристаллы. Устойчива в двух модификациях - ромбической (плотность 2,07 г/см 3 , t пл 112,8°C) и моноклинной (плотность 1,96 г/см 3 , t пл 119°C). В воде нерастворима. На воздухе устойчива; при горении даёт SO 2 , с металлами образует сульфиды. В природе - самородная сера, сульфиды, сульфаты. Серу выплавляют из самородных руд; получают также окислением кислородом воздуха сероводорода, содержащегося в природном, нефтяном, коксовом газах, и другими методами. Около 50% серы идёт на получение серной кислоты, 25% - на получение сульфитов (используются в бумажной промышленности), остальная - для борьбы с болезнями растений, вулканизации, синтеза красителей, производства спичек и др.
СЕРАСЕ́РА (лат. Sulfur), S, химический элемент с атомным номером 16, атомная масса 32,066. Химический символ серы S произносится «эс». Природная сера состоит из четырех стабильных нуклидов (см.
НУКЛИД)
: 32 S (содержание 95,084% по массе), 33 S (0,74 %), 34 S (4,16%) и 36 S (0,016 %). Радиус атома серы 0,104 нм. Радиусы ионов: иона S 2– 0,170 нм (координационное число 6), иона S 4+ 0,051 нм (координационное число 6) и иона S 6+ 0,026 нм (координационное число 4). Энергии последовательной ионизации нейтрального атома серы от S 0 до S 6+ равны, соответственно, 10,36, 23,35, 34,8, 47,3, 72,5 и 88,0 эВ. Сера расположена в VIA группе периодической системы Д. И. Менделеева, в 3-м периоде, и принадлежит к числу халькогенов. Конфигурация внешнего электронного слоя 3s
2
3p
4
. Наиболее характерны степени окисления в соединениях –2, +4, +6 (валентности соответственно II, IV и VI). Значение электроотрицательности серы по Полингу 2,6. Сера относится к числу неметаллов.
В свободном виде сера представляет собой желтые хрупкие кристаллы или желтый порошок.
Историческая справка
Сера встречается в природе в свободном (самородном) состоянии, поэтому она была известна человеку уже в глубокой древности. Сера привлекала внимание характерной окраской, голубым цветом пламени и специфическим запахом, возникающим при горении (запах сернистого газа). Считалось, что горящая сера отгоняет нечистую силу. В Библии говорится об использовании серы для очищения грешников. У человека средневековья запах «серы» ассоциировался с преисподней. Применение горящей серы для дезинфекции упоминается Гомером. В Древнем Риме с помощью сернистого газа отбеливали ткани.
Издавна использовалась сера в медицине - ее пламенем окуривали больных, ее включали в состав различных мазей для лечения кожных заболеваний. В 11 в. Авиценна (Ибн Сина (см.
ИБН СИНА)
), а затем и европейские алхимики полагали, что металлы, в том числе золото и серебро, состоят из находящихся в различных соотношениях серы и ртути. Поэтому сера играла важную роль в попытках алхимиков найти «философский камень» и превратить недрагоценные металлы в драгоценные. В 16 в. Парацельс (см.
ПАРАЦЕЛЬС)
считал серу наряду с ртутью и «солью» одним из основных «начал» природы, «душою» всех тел.
Практическое значение серы резко возросло после того, как изобрели черный порох (в состав которого обязательно входит сера). Византийцы в 673 г., защищая Константинополь, сожгли флот неприятеля с помощью так называемого греческого огня - смеси селитры, серы, смолы и других веществ - пламя которого не гасилось водой. В средние века в Европе применялся черный порох, по составу близкий к смеси греческого огня. С тех пор началось широкое использование серы для военных целей.
Издавна было известно и важнейшее соединение серы - серная кислота. Один из создателей ятрохимии (см.
ЯТРОХИМИЯ)
, монах Василий Валентин, в 15 в. подробно описал получение серной кислоты путем прокаливания железного купороса (старинное название серной кислоты - купоросное масло).
Элементарную природу серы установил в 1789 А. Лавуазье (см.
ЛАВУАЗЬЕ Антуан Лоран)
. В названиях химических соединений, содержащих серу, часто содержится приставка «тио» (например, применяемый в фотографии реактив Na 2 S 2 O 3 имеет название тиосульфат натрия). Происхождение этой приставки связано с греческим названием серы - theion.
Нахождение в природе
Сера довольно широко распространена в природе. В земной коре ее содержание оценивается в 0,05% по массе. В природе часто встречаются значительные залежи самородной серы (обычно вблизи вулканов); в Европе они расположены на юге Италии, в Сицилии. Большие залежи самородной серы имеются в США (в штатах Луизиана и Техас), а также в Средней Азии, в Японии, в Мексике. В природе сера встречается как россыпями, так и в виде кристаллических пластов, иногда образуя изумительные по красоте группы полупрозрачных желтых кристаллов (так называемые друзы).
В вулканических местностях часто наблюдается выделение из-под земли газа сероводорода H 2 S; в этих же регионах сероводород встречается в растворенном виде в серных водах. Вулканические газы часто содержат также сернистый газ SO 2 .
На поверхности нашей планеты широко распространены месторождения различных сульфидных соединений. Наиболее часто среди них встречаются: железный колчедан (пирит (см.
ПИРИТ)
) FeS 2 , медный колчедан (халькопирит) CuFeS 2 , свинцовый блеск (см.
ГАЛЕНИТ)
PbS, киноварь (см.
КИНОВАРЬ)
HgS, сфалерит (см.
СФАЛЕРИТ)
ZnS и его кристалическая модификация вюртцит (см.
ВЮРТЦИТ)
, антимонит (см.
АНТИМОНИТ)
Sb 2 S 3 и другие. Известны также многочисленные месторождения различных сульфатов, например, сульфата кальция (гипс CaSO 4 ·2H 2 O и ангидрит CaSO 4), сульфата магния MgSO 4 (горькая соль), сульфата бария BaSO 4 (барит), сульфата стронция SrSO 4 (целестин), сульфата натрия Na 2 SO 4 ·10H 2 O (мирабилит) и др.
Каменные угли содержат в среднем 1,0-1,5% серы. Сера может входить и в состав нефти. Целый ряд месторождений природного горючего газа (например, Астраханское) содержат как примесь сероводород.
Сера относится к элементам, которые необходимы для живых организмов, так как она является существенной составной частью белков. Белки содержат 0,8-2,4% (по массе) химически связанной серы. Растения получают серу из сульфатов, содержащихся в почве. Неприятные запахи, возникающие при гниении трупов животных, объясняются главным образом выделением соединений серы (сероводорода и меркаптанов (см.
ТИОЛЫ)
), образующихся при разложении белков. В морской воде присутствует около 8,7·10 -2 % серы.
Получение
Серу получают, в основном, выплавляя ее из горных пород, содержащих самородную (элементарную) серу. Так называемый геотехнологический способ позволяет получать серу без подъема руды на поверхность. Этот способ был предложен в конце 19 в. американским химиком Г. Фрашем, перед которым встала задача извлечения на поверхность земли серы из месторождений юга США, где песчаный грунт резко усложнял ее добычу традиционным шахтным методом.
Фраш предложил использовать для подъема серы на поверхность перегретый водяной пар. Перегретый пар по трубе подают в подземный слой, содержащий серу. Сера плавится (ее температура плавления немного ниже 120°С) и по трубе, расположенной внутри той, по которой под землю закачивают водяной пар, поднимается наверх. Для того, чтобы обеспечить подъем жидкой серы, через самую тонкую внутреннюю трубу нагнетают сжатый воздух.
По другому (термическому) методу, получившему особое распространение в начале 20 в. на Сицилии, серу выплавляют, или возгоняют, из дробленной горной породы в специальных глиняных печах.
Существуют и другие методы выделения самородной серы из породы, например, экстракцией сероуглеродом или флотационными методами.
В связи с тем, что потребность промышленности в сере очень велика, разработаны методы ее получения из сероводорода H 2 S и сульфатов.
Метод окисления сероводорода до элементарной серы был впервые разработан в Великобритании, где значительные количества серы научились получать из остающегося после получении соды Na 2 CO 3 по методу французского химика Н. Леблана (см.
ЛЕБЛАН Никола)
сульфида кальция CaS. Метод Леблана основан на восстановлении сульфата натрия углем в присутствии известняка CaCO 3 .
Na 2 SO 4 + 2C = Na 2 S + 2CO 2 ;
Na 2 S + CaCO 3 = Na 2 CO 3 + CaS.
Соду затем выщелачивают водой, а водную суспензию плохо растворимого сульфида кальция обрабатывают диоксидом углерода:
CaS + CO 2 + H 2 O = CaCO 3 + H 2 S
Образующийся сероводород H 2 S в смеси с воздухом пропускают в печи над слоем катализатора. При этом за счет неполного окисления сероводорода образуется сера:
2H 2 S + O 2 = 2H 2 O +2S
Аналогичный метод используют для получения элементарной серы и из сероводорода, сопутствующего природным газам.
Так как современная техника нуждается в сере высокой чистоты, разработаны эффективные методы рафинирования серы. При этом используют, в частности, различия в химическом поведении серы и примесей. Так, мышьяк и селен удаляют, обработав серу смесью азотной и серной кислот.
Использованием методов, основанных на дистилляции и ректификации, удается получить высокочистую серу с содержанием примесей 10 –5 –10 –6 % по массе.
Физические и химические свойства
Атомы серы обладают уникальной способностью образовывать устойчивые гомоцепи, т. е. цепи, состоящие только из атомов S (энергия связи S–S составляет около 260 кДж/моль). Гомоцепи серы имеют зигзагообразную форму, так как в их образовании принимают участие электроны, расположенные в соседних атомах на взаимно перпендикулярных р-орбиталях. Эти цепи могут достигать большой длины, или, наоборот, образовывать замкнутые кольца S 20 , S 8 , S 6 , S 4 .
Поэтому сера образует несколько десятков как кристаллических, так и аморфных модификаций, отличающихся как составом молекул и полимерных цепей, так и способом их упаковки в твердом состоянии.
При нормальном давлении и температурах до 98,38 °C стабильна a-модификация серы (иначе эту модификацию называют ромбической), образующая лимонно-желтые кристаллы. Ее кристаллическая решетка орторомбическая, параметры элементарной ячейки a = 1,04646, b = 1,28660, c = 2,4486 нм. Плотность 2,07 кг/дм 3 . Выше 95,39 °C стабильна b -модификация серы (так называемая моноклинная сера). При комнатной температуре параметры элементарной ячейки моноклинной b-S a = 1.090, b = 1.096, c = 1,102 нм, t = 83,27 °С. Плотность b-S 1,96 кг/дм 3 .
В структурах как a-, так и b-модификаций серы имеются неплоские восьмичленные циклические молекулы S 8 . Такие молекулы немного похожи на короны.
Две эти модификации серы отличаются взаимной ориентацией молекул S 8 в кристаллической решетке.
Еще одну модификацию серы - так называемую ромбоэдрическую серу - можно получить выливанием раствора тиосульфата натрия Na 2 S 2 O 3 в концентрированную соляную кислоту при 0 °C с последующей экстракцией серы толуолом (см.
ТОЛУОЛ)
. После испарения растворителя возникают ромбоэдрические кристаллы, содержащие молекулы S 6 в форме кресла.
Аморфную серу (плотность 1,92 г/см 3) и резиноподобную пластическую серу получают при резком охлаждении расплавленной серы (выливая расплав в холодную воду). Эти модификации состоят из нерегулярных зигзагообразных цепей S n . При длительном выдерживании при температурах 20-95 °C все модификации серы превращаются в a-серу.
Температура плавления ромбической a -серы 112,8 °С, а моноклинной b-серы 119,3 °С. И в том, и в другом случае образуется легкоподвижная желтая жидкость, которая при температуре около 160 °С темнеет; ее вязкость повышается, и при температуре выше 200 °С расплавленная сера становится темно-коричневой и вязкой, как смола. Это объясняется тем, что сначала в расплаве разрушаются кольцевые молекулы S 8 . Возникающие фрагменты объединяются друг с другом с образованием длинных цепей S µ из нескольких сотен тысяч атомов. Дальнейшее нагревание расплавленной серы (выше температуры 250 °C) ведет к частичному разрыву цепей, и жидкость снова становится более подвижной. На рис. показана температурная зависимость вязкости жидкой серы. Около 190 °C ее вязкость примерно в 9000 раз больше, чем при 160 °C.
При температуре 444,6 °C расплавленная сера закипает. В зависимости от температуры в ее парах можно обнаружить молекулы S 8 , S 6 , S 4 и S 2 . Изменение состава молекул вызывает изменение окраски паров серы от оранжево-желтого до соломенно-желтого цвета. При температуре выше 1500 °C молекулы S 2 диссоциируют на атомы.
Молекулы S 2 парамагнитны (см.
ПАРАМАГНЕТИК)
и построены аналогично молекуле O 2 . Во всех других состояниях сера диамагнитна (см.
ДИАМАГНЕТИК)
.
В воде сера практически нерастворима. Некоторые ее модификации растворяются в органических жидкостях (толуоле, бензоле) и особенно хорошо - в сероуглероде CS 2 и жидком аммиаке NH 3 .
Сера - достаточно активный неметалл. Даже при умеренном нагревании она окисляет многие простые вещества, но и сама довольно легко окисляется кислородом и галогенами.
S + O 2 = SO 2 , S + 3F 2 = SF 6 ,
2S + Cl 2 = S 2 Cl 2 (c примесью SCl 2)
С водородом при нагревании сера образует сероводород H 2 S и в небольшом количестве сульфаны (соединения состава H 2 S n):
H 2 + S H 2 S.
Примеры реакций серы с металлами:
2Na + S = Na 2 S, Ca + S = CaS, Fe + S = FeS
Образующиеся в этих реакциях сульфиды характеризуются не постоянным, а, как правило, переменным составом. Так, состав сульфида кальция может непрерывно изменяться в границах от CaS до CaS 5 . Полисульфиды типа СаS n или Na 2 S n при взаимодействии, например, с соляной кислотой образуют сульфаны H 2 S n
, причем значение n может составлять от 1 до приблизительно 10.
Концентрированная серная кислота при нагревании окисляет серу до SO 2:
S + 2H 2 SO 4 = 2H 2 O + 3SO 2 .
Царская водка (смесь азотной и соляной кислот) окисляет серу до серной кислоты.
Разбавленная азотная кислота, соляная кислота без окислителей и серная кислота на холоде с серой во взаимодействие не вступают. При нагревании в кипящей воде или растворах щелочей сера диспропорционирует:
3S + 6NaOH 2Na 2 S + Na 2 SO 3 + 3H 2 O;
Сера может присоединяться к сульфидам
Na 2 S + (n–1)S = Na 2 S n
и к сульфитам:
Na 2 SO 3 + S = Na 2 S 2 O 3
В результате протекания данной реакции из сульфита натрия Na 2 SO 3 образуется тиосульфат натрия Na 2 S 2 O 3 .
При нагревании сера реагирует почти со всеми элементами, кроме инертных газов, иода, азота, платины и золота.
Известно несколько оксидов серы. Кроме устойчивых диоксида серы SO 2 [другие названия: сернистый газ, сернистый ангидрид, оксид серы (IV)] и триоксида серы SO 3 [другие названия: серный газ, серный ангидрид, оксид серы (VI)], получены неустойчивые оксиды S 2 O (при пропускании тока SO 2 через тлеющий разряд) и S 8 O (при взаимодействии H 2 S c SOCl 2). Пероксиды SO 4 и S 2 O 7 образуются при пропускании SO 2 в смеси с кислородом через тлеющий разряд или за счет окисления SO 2 озоном.
Кислотному диоксиду серы SO 2 соответствует неустойчивая кислота средней силы H 2 SO 3 (сернистая кислота):
Н 2 О + SO 2 H 2 SO 3 ,
а кислотному триоксиду серы SO 3 - сильная двухосновная серная кислота (см.
СЕРНАЯ КИСЛОТА)
H 2 SO 4:
SO 3 + H 2 O = H 2 SO 4
И сернистой кислоте H 2 SO 3 , и серной H 2 SO 4 соответствуют по два ряда солей: кислые [соответственно гидросульфиты NaHSO 3 , Ca(HSO 3) 2 и др. и гидросульфаты КНSO 4 , NaНSO 4 и другие] и средние [сульфиты Na 2 SO 3 , K 2 SO 3 и сульфаты CaSO 4 , Fe 2 (SO 4) 3 ].
Сера входит в состав многих органических соединений (см. статьи Тиофен (см.
ТИОФЕН)
, Тиолы (см.
ТИОЛЫ)
и другие).
Применение
Около половины производимой серы используется на производство серной кислоты, около 25% расходуется для получения сульфитов, 10-15% - для борьбы с вредителями сельскохозяйственных культур (главным образом винограда и хлопчатника) (наибольшее значение здесь имеет раствор медного купороса CuSO 4 ·5H 2 O), около 10% используется резиновой промышленностью для вулканизации резины. Серу применяют при производстве красителей и пигментов, взрывчатых веществ (она до сих пор входит в состав пороха), искусственных волокон, люминофоров (см.
ЛЮМИНОФОРЫ)
. Серу используют при производстве спичек, так как она входит в состав, из которого изготовляют головки спичек. Серу до сих пор содержат некоторые мази, которыми лечат заболевания кожи. Для придания сталям особых свойств в них вводят небольшие добавки серы (хотя, как правило, примесь серы в сталях нежелательна).
Биологическая роль
Сера постоянно присутствует во всех живых организмах, являясь важным биогенным элементом (см.
БИОГЕННЫЕ ЭЛЕМЕНТЫ)
. Ее содержание в растениях составляет 0,3-1,2 %, в животных 0,5-2 % (морские организмы содержат больше серы, чем наземные). Биологическое значение серы определяется прежде всего тем, что она входит в состав аминокислот метионина (см.
МЕТИОНИН)
и цистеина (см.
ЦИСТЕИН)
и, следовательно, в состав пептидов (см.
ПЕПТИДЫ)
и белков. Дисульфидные связи –S–S– в полипетидных цепях участвуют в формировании пространственной структуры белков, а сульфгидрильные группы (–SH) играют важную роль в активных центрах ферментов. Кроме того, сера входит в молекулы гормонов, важных веществ. Много серы содержится в кератине волос, костях, нервной ткани. Неорганические соединения серы необходимы для минерального питания растений. Они служат субстратами окислительных реакций, осуществляемых распространенными в природе серобактериями (см.
СЕРОБАКТЕРИИ)
.
В организме среднего человека (масса тела 70 кг) содержится около 1402 г серы. Суточная потребность взрослого человека в сере - около 4.
Однако по своему отрицательному воздействию на окружающую среду и человека сера (точнее, ее соединения) стоит на одном из первых мест. Основной источник загрязнения серой - сжигание каменного угля и других видов топлива, содержащих серу. При этом около 96% серы, содержащейся в топливе, попадает в атмосферу в виде сернистого газа SO 2 .
В атмосфере сернистый газ постепенно окисляется до оксида серы (VI). Оба оксида - и оксид серы (IV), и оксид серы (VI) - взаимодействуют с парами воды с образованием кислотного раствора. Затем эти растворы выпадают в виде кислотных дождей. Оказавшись в почве, кислотные воды угнетают развитие почвенной фауны и растений. В результате создаются неблагоприятные условия для развития растительности, особенно в северных регионах, где к суровому климату добавляется химическое загрязнение. В результате гибнут леса, нарушается травяной покров, ухудшается состояние водоемов. Кислотные дожди разрушают изготовленные из мрамора и других материалов памятники, более того, они вызывают разрушение даже каменных зданий и изделий из металлов. Поэтому приходится принимать разнообразные меры по предотвращению попадания соединений серы из топлива в атмосферу. Для этого подвергают очистке от соединений серы нефть и нефтепродукты, очищают образующиеся при сжигании топлива газы.
Сама по себе сера в виде пыли раздражает слизистые оболочки, органы дыхания и может вызывать серьезные заболевания. ПДК серы в воздухе 0,07 мг/м 3 .
Жен. одно из простых (несложных, неразлагаемых) веществ, плавкое и сильно горючее ископаемое вулканического рожденья; как товар, зовут ее: сера горючая. Порох делается из селитры и серы, с углем. Черенковая сера, отлитая палочками. | Сера, серка … Толковый словарь Даля
СЕРА - СЕРА, Sulfur, хим. элемент VІ гр. Менделеевской системы, символ S, порядковый номер 16, ат. в. 32,07. Известна с древнейших времен. В природе встречается в виде залежей водного (нептунического) и вулканического. происхождения. Встречается также в … Большая медицинская энциклопедия
СЕРА - хим. элемент, символ S (лат. Sulfur), ат. н. 16, ат. м. 32,06. Существует в виде нескольких аллотропных модификаций; среди них сера моноклинной модификации (плотность 1960 кг/м3, tпл = 119°С) и ромбическая сера (плотность 2070 кг/м3, ίπι = 112,8… … Большая политехническая энциклопедия
- (обозначается S), химический элемент VI группы ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ, неметалл, известный с древности. Встречается в природе как в виде отдельного элемента, так и в виде сульфидных минералов, таких как ГАЛЕНИТ и ПИРИТ, и сульфатных минералов,… … Научно-технический энциклопедический словарь
В мифологии ирландских кельтов Сера отец Парталона (см. глава 6). Согласно некоторым источникам, именно Сера, а не Парталон был мужем Дилгнейд. (
Возможно, будет полезно почитать:
- Патриарх кирилл запретил актеру и священнику ивану охлобыстину служить в церкви Охлобыстин церковный сан ;
- Иван охлобыстин - биография, информация, личная жизнь Почему охлобыстин ушел из священников ;
- Ужин для ребенка 4 лет рецепты меню ;
- Принципы функционирования бюджетной системы РФ ;
- Особенности размещения населения на территории земли Население земли размещается равномерно средняя плотность населения ;
- Тонька-пулеметчица — cтрашная судьба страшного человека Фильм палач тонька пулеметчица реальная история ;
- Как поздравить начальницу с юбилеем? ;
- Российские студенты выиграли чемпионат мира по программированию Вот они, герои ;